Schnelles Screening und Quantifizieren von Pestizidrückständen in Cannabis durch modifizierte QuEChERS-Methode und LC-MS-Analyse
Sowohl der Freizeit- als auch der medizinische Konsum von Marihuana (Cannabis spp.) nimmt in der Vereinigten Staaten in rasantem Tempo zu. Dadurch hat sich die inländische Produktion in den letzten 25 Jahren mehr als verzehnfacht. Diese extrem hochwertige Nutzpflanze ist allerdings anfällig für Schimmel und insektenbefall, weshalb die Anbauer häufig zum Schutz ihrer Pflanzen Pestizide und Antimykotika einsetzen. Chemische Rückstände dieser eingesetzten Substanzen an der Pflanze können eine Gefahr für den Verbraucher bzw. Konsumenten darstellen, so dass hochempfindliche und selektive Methoden für ihren Nachweis in der komplexen Cannabismatrix erforderlich sind. Shimadzu entwickelte eine schnelle und effektive LC-MS/MS Methode mit modifizierter QuEChERS-Probenvorbereitung zum Nachweis von fast 200 chemischen Rückständen in getrocknetem Cannabisblüten. Die so erstellte Methode wurde zum Testen einer großen Auswahl von Produkten, die zum kommerziellen Verkauf angeboten werden, verwendet.
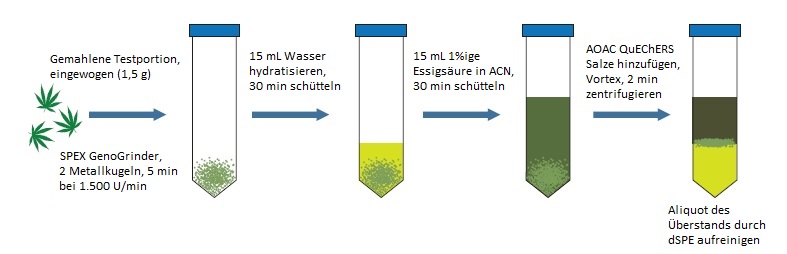
Abbildung 1 Modifizierte QuEChERS-Extraktion
Methode
Testportionen von getrockneten Cannabisblüten wurden homogenisiert und mit einer modifizierten QuEChERS-Extraktion mit dispersiver SPE-Aufreinigung extrahiert (Restek Kat. Nr. 26237 und 26243). Eine SPEX GenoGrinder diente während der Probenvorbereitung zum Mahlen. Die massenspektrometrische Analyse wurde unter Verwendung des Triple-Quadrupol-Massenspektrometers LCMS-8050 und einer Prominence-HPLC von Shimadzu realisiert. Zur Ionisierung der Analyten wurde eine ESI-Quelle gewählt. Zusätzlich wurde die Messung bei kontinuierlichen Polaritätswechsel durchgeführt, um die Proben während des gesamten Laufs in beiden Modi zu erfassen. Die Gehaltsbestimmungen der Pestizide wurden mit Hilfe von Aufstockungsexperimenten und matrixangepassten Kalibrierungen ermittelt. Alle Analysen wurden in einem zertifizierten Cannabis-Testlabor im Bundesstaat Washington vorgenommen.
Tabelle 1 LCMS-8050 Geräteparameter
| LC-Säule | Restek ARC-18 (2.1×100 mm, 3 μm) |
| Mobile Phase A | 5 mM NH4OAC + 0,1% Ameisensäure |
| Mobile Phase B | Methanol |
| LC-Durchflussrate | 0,5 mL/min |
| Heizgas | 10 L/min |
| Schnittstellen-Temp. | 400°C |
| Zerstäubungsgas | 3 L/min |
| Trocknungsgas | 10 L/min |
| DL-Temp. | 250°C |
| Wärmeblock-Temp. | 400°C |

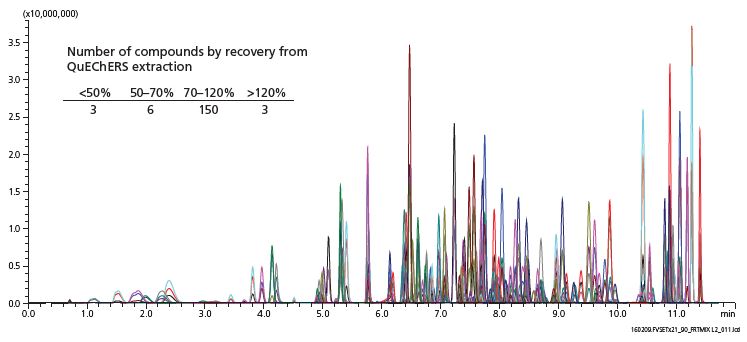
Abbildung 2 (oben) Cannabisproben für Pestizidtests
Abbildung 3 (unten) Repräsentatives Chromatogramm und Anzahl der Verbindungen nach Wiederfindung (Einfügung)
Ergebnisse und Diskussion
Die QuEChERS-Extraktion in Verbindung mit dispersiver SPE ergab die beste Kombination aus Pestizidrückgewinnung und Aufreinigung der getrockneten Cannabisproben. Innerhalb der gesetzten Quantifizierungsgrenzen der zu untersuchenden Komponenten waren die matrix-angepassten Kalibrierkurven linear. Diese Quantifizierungsgrenzen sind abhängig der jeweiligen Verbindungen, von 20 ppb oder weniger bis hin zu mehr als 500 ppb. Als Nachweis- und Bestimmungsgrenzen wurden die Werte für das Signal-Rausch-Verhältnis von 3:1 bzw. 10:1 festgelegt, zudem musste für das Erreichen des Quantifizierungslimits bei einer dreifachen Analyse die relative Standardabweichung weniger als 20% aufweisen. Die Wiederfindungsraten waren verbindungsabhängig, aber die Mehrheit lag im Bereich von 70-120%, während Ausreißer oberhalb und unterhalb des Bereiches beobachtet wurden. Diese Methode wurde bei drei verschiedenen Cannabis-Stämmen validiert, unter Verwendung der matrixangepassten Kalibrierkurven und Triplikaten von Qualitätskontrollen über drei Level. In eine Gruppe von zufällig getesteten Cannabisproben, die zum kommerziellen Verkauf angeboten wurden, waren die drei am häufigsten nachgewiesenen Rückstände Piperonylbutoxid, Myclobutanil und Boscalid. Die Konzentrationen für Pestizide reichten von der Nachweisgrenze bis in den Mikrogramm/Gramm-Bereich.
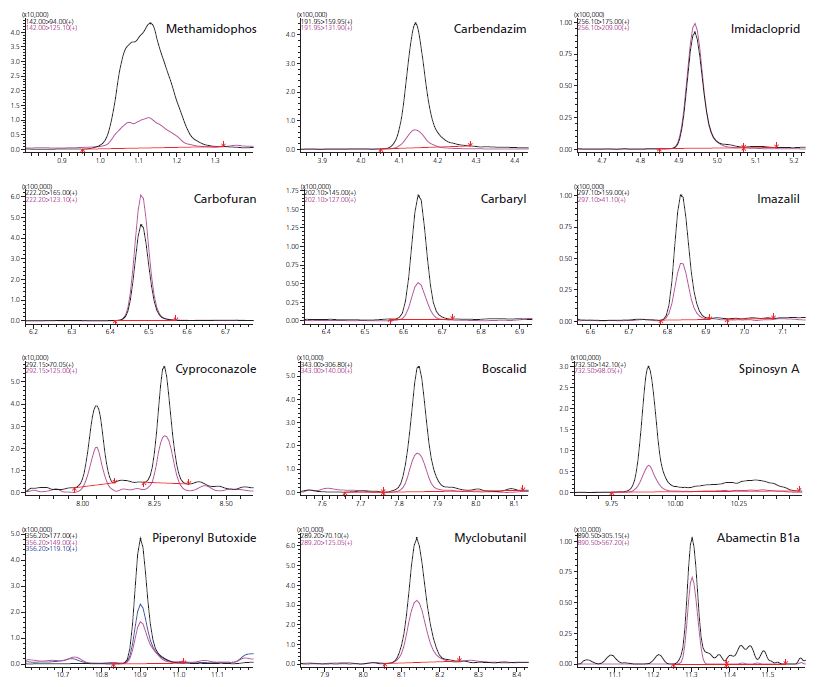
Abbildung 4 Repräsentative individuelle Chromatogramme bei 100 ng/g getrocknetem Cannabis (Abamectin-Chromatogramm ab 1 mcg/g)
Tabelle 2 Nachweis von Pestiziden in 39 getrockneten Blütenproben, die im Einzelverkauf angeboten wurden
| Probe | Rückstand entdeckt | mcg/g | Probe | Rückstand entdeckt | mcg/g |
|---|---|---|---|---|---|
| A | P | Piperonylbutoxid | 0,32 | ||
| B | Q | Imidacloprid | 0,49 | ||
| C | R | ||||
| D | S | Piperonylbutoxid | 0,69 | ||
| E | T | ||||
| F | U | Myclobutanil | 0,02 | ||
| G | Piperonylbutoxid | 0,53 | V | ||
| H | Piperonylbutoxid | 0,05 | W | Piperonylbutoxid | 12,46 |
| I | X | Piperonylbutoxid | 0,16 | ||
| J | Spinosyn A | 0,02 | Fipronil | 0,04 | |
| Spinosyn D | 0,02 | Y | |||
| K | Myclobutanil | 0,01 | Z | ||
| L | Myclobutanil | 0,02 | AA | ||
| M | Dinotefuran | 13,44 | AB | ||
| Boscalid | 81,79 | AC | Piperonylbutoxid | 14,99 | |
| Pyraclostrobin | 0,40 | AD | Pemethrin | 0,35 | |
| Tri oxystrobin | 0,08 | AE | |||
| Fludioxonil | 0,42 | AF | Piperonylbutoxid | 0,08 | |
| Myclobutanil | 1,21 | AG | |||
| N | Dinotefuran | 1,20 | AH | ||
| Boscalid | 5,79 | AI | |||
| Fludioxonil | 0,01 | AJ | Diuron | 0,06 | |
| Myclobutanil | 0,08 | AK | Piperonylbutoxid | 0,13 | |
| O | Boscalid | 0,15 | AL | ||
| Myclobutanil | 0,05 | AM |
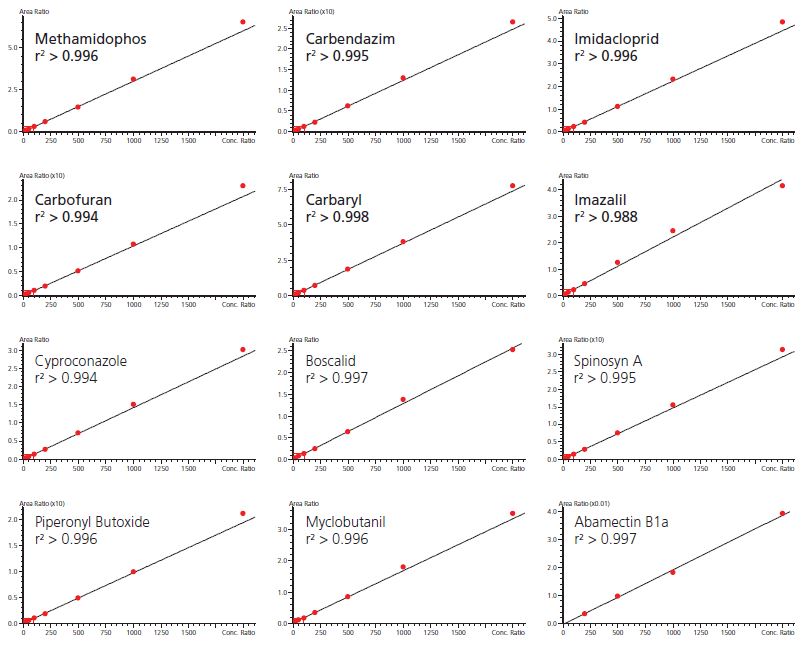

Abbildung 5 (oben) Repräsentative Kalibrierkurven
Abbildung 6 (unten) Probenvorbereitung
Tabelle 3 In 39 getrockneten Blütenproben nachgewiesene Pestizide
| Rückstandsname | Bestimmungen | Rate |
|---|---|---|
| Boscalid | 3 | 7,7 % |
| Dinotefuran | 2 | 5,1 % |
| Diuron | 1 | 2,6 % |
| Fipronil | 1 | 2,6 % |
| Fludioxonil | 2 | 5,1 % |
| Imidacloprid | 1 | 2,6 % |
| Myclobutanil | 6 | 15,4 % |
| Permethrin | 1 | 2,6 % |
| Piperonyl butoxide | 9 | 23,1 % |
| Pyraclostrobin | 1 | 2,6 % |
| Spinosyn A | 1 | 2,6 % |
| Spinosyn D | 1 | 2,6 % |
| Trifloxystrobin | 1 | 2,6 % |
| Eins oder mehr | 19 | 49 % |
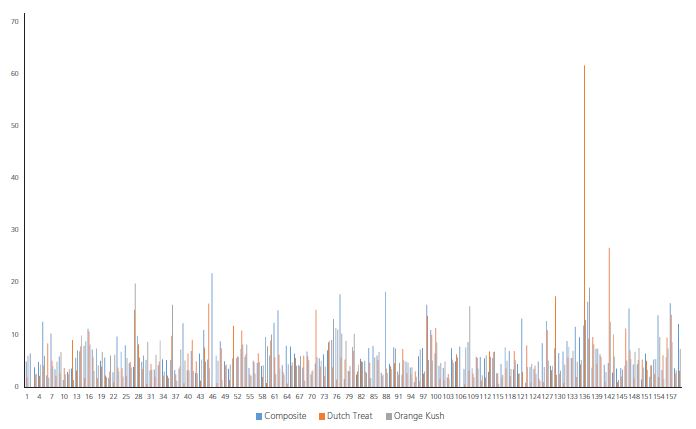
Abbildung 7 RSD für jede Verbindung in drei QC-Dreifachproben auf der 50 ng/g-Spike-Ebene in drei Matrizen
Fazit
Es wurde eine validierte Methode zum Nachweis chemischer Rückstände in getrockneten Cannabisproben entwickelt. Unsere Methode kann geringe Mengen gängiger Pestizide in Proben, die für den Einzelhandel angeboten werden, mit ausgezeichneter Selektivität und Geschwindigkeit nachweisen. Es sollen noch weitere Messungen an einer größeren Auswahl kommerziell erhältlicher Cannabisproben durchgeführt werden.