Einfache Auswertung kultivierter Zellen: Bewertung des Differenzierungszustandes von iPS-Zellen unter Verwendung eines benchtop MALDI-TOF MS
Der Wachstums- und Differenzierungszustand (differenziert oder undifferenziert) der kultivierten Zellen sind wichtige Bewertungspunkte in der regenerativen Medizin und Grundlagenforschung. Eine solche Beurteilung der Zellen mittels die Massenspektrometrie könnte eine deutliche Reduzierung des Arbeitsaufwandes und der Zeit für die Datenauswertung erreichen.
Um die Möglichkeit der massenspektrometrischen Zustandsbestimmung von Zellen zu prüfen, haben wir daher eine automatische Analyse von iPS-Zellen und ihren Kulturmedien durch die Softwareoption AuraSolution in Kombination mit dem Shimadzu MALDI-8020 Benchtop-Linear-MALDI-TOF Massenspektrometer durchgeführt und eine vorläufige Analyse mit der statistischen Analysesoftware eMSTAT Solution™ versucht. Im folgendem Artikel werden die Ergebnisse vorgestellt.
Probenvorbereitung
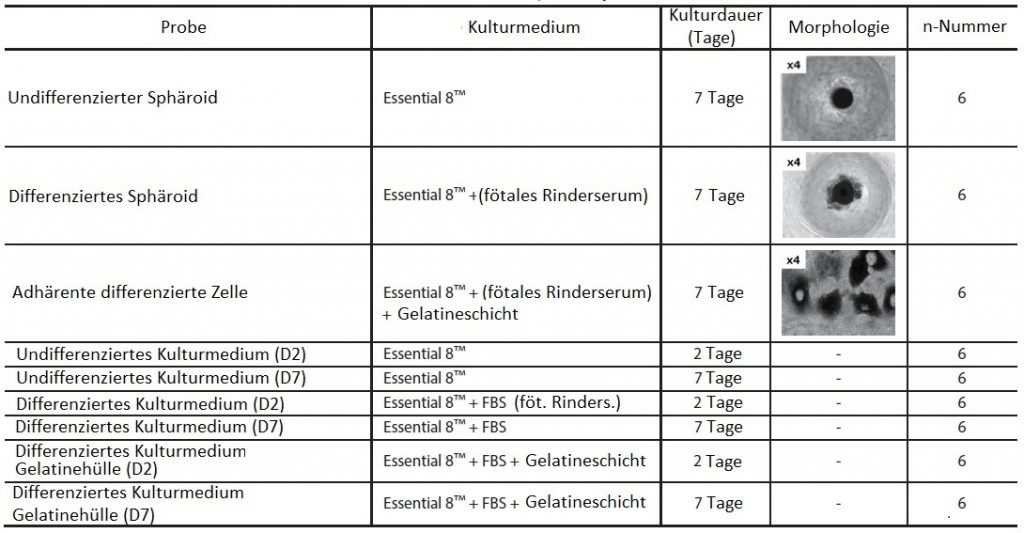
Als kultivierte Zellproben und Kulturmediumproben wurden die in Tabelle 1 dargestellten iPS-Zellen und Kulturmedien in verschiedenen Stadien der Kultivierung verwendet. Während der Kultivierung wurde die Hälfte des Kulturmediums jeden zweiten Tag durch frisches Medium ersetzt. Mittels quantitativer PCR (Polymerase-Kettenreaktion) verglichen wir die relativen Expressionsmengen der differenzierten/undifferenzierten Marker OCT3/4 und NANOG (undifferenzierter Marker), SOX1 (Exoderm-Marker) und SOX17 (Endoderm-Marker) mit den Zellen in den verschiedenen Kulturstadien. Die Ergebnisse legten nahe, dass die Differenzierung vom undifferenzierten Zustand über einen Übergangszustand von undifferenzierten Sphäroiden zu differenzierten Sphäroiden und dann zu adhärenten differenzierten Zellen fortschreitet.
Für die massenspektrometrischen Analysen der Zellen wurden nach Rückgewinnung und zweimaligem Waschen der jeweiligen kultivierten Zellen mit einem PBS-Puffer durch kurzzeitige Ultraschallreinigung unter 10 %iger Trichloressigsäure und Zentrifugieren bei 10.000 xg für 1 min Pellets erhalten. Die zurückgewonnenen Pellets wurden in einer kleinen Menge einer Acetonitril-Lösung suspendiert, und die Suspension (1 μL) wurde mit CHCA (α-Cyano-4-hydroxyzimtsäure, 1 μL) gemischt, das bis zu einer Konzentration von 5 mg/mL in der Matrixlösung (50 %ige Acetonitril-Lösung mit 0,1 % Trifluoressigsäure) gelöst worden war. Diese Mischung wurde auf das MALDI-Probentarget gegeben, getrocknet und dann gemessen.
Zur Vorbereitung der Kulturmediummessung wurde die volle Menge einer Mischung aus dem Kulturüberstand (0,5 μL) und der CHCA-Lösung (wie oben, 0,5 μL) auf das MALDI-Probentarget gegeben, getrocknet und dann gemessen.
Tabelle 1 Liste der Analyseproben
MALDI-TOF MS Messung von Analyseproben
Die auf die MALDI-Probentargets applizierten Proben wurden in das MALDI-8020 Massenspektrometer eingebracht und anschließend mit Hilfe der automatischen Analysesoftware SampleStation/AuroSolution vermessen. Tabelle 2 zeigt die Messparameter bei der automatischen Analyse. Abb. 1 zeigt ein Beispiel für ein Massenspektrum.
Tabelle 2 Aufnahmeparameter MALDI-MS
| MESSUNG ZELLKULTUR | |
| Tuning | linear |
| Polarität | positiv |
| Massenbereich | 2.000-30.000 Da |
| Laser-Reproduktionsrate | 200 Hz |
| Akkumulationsrate (Laserschüsse/Spektrum) | 20 |
| Spektren | 1.156 |
| Aufnahmemethode | Raster |
| MESSUNG DES KULTURÜBERSTANDES | |
| Abstimmung | Linear |
| Polarität | Positiv |
| Massenbereich | 2.000-30.000 Da |
| Laser-Reproduktionsrate (Laserschüsse/Profil) | 200 Hz |
| Akkumulationsrate (Laserschüsse/Profil) | 20 |
| Profile | 676 |
| Stichprobenmethode | Raster |
Analyse von MS-Daten durch eMSTAT Solution
Als Resultat der Analyse der MS-Daten, die durch die automatische Analyse mit der Software eMSTAT Solution gewonnen wurden, konnten die undifferenzierten Sphäroide, die differenzierten Sphäroide und die adhärenten differenzierten Zellen, die sieben Tage lang unter den jeweiligen Kulturbedingungen kultiviert wurden, entsprechend gruppiert werden, wie in Abb. 2 dargestellt. Bezüglich der Kulturmedien ergab es eine zusätzliche Gruppierung nach Kulturzeit (Tagen). Zudem konnte festgestellt werden, dass die differenzierten Kulturmedien (D7) des siebten Tages der Kultivierung, die Sphäroide bildeten, eine weitere Gruppe geschaffen haben, die dem differenzierten Kulturmedium (D2) und dem differenzierten Kulturmedium (D7) mit Gelatineschicht nahe standen, welches Kulturmedium ebenfalls dem der adhärenten differenzierten Zellen entsprach.
Die Ergebnisse lassen eine bequeme und schnelle Möglichkeit vermuten, um Wachstums und Differenzierungszustände der Zellen zu ermitteln. Dabei unterstützt die Verwendung einer Kombination aus automatischer Analysesoftware, die für die Verarbeitung mehrerer Proben geeignet ist, und der statistischen Analysesoftware eMSTAT Solution, basierend auf dem einfachen linearen Benchtop-MALDI-TOF-Massenspektrometer MALDI-8020.
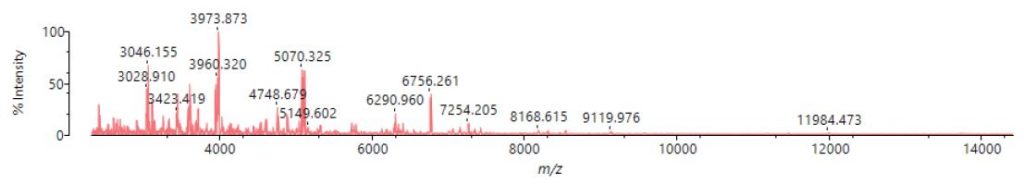
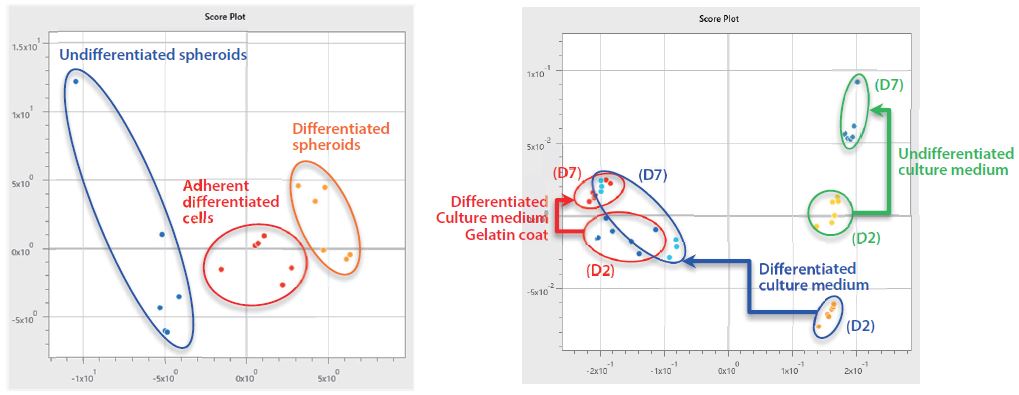
Abb. 1 (oben) Beispiel des Massenspektrums von iPS-Zellen, die durch direkte Messung erhalten wurden
Abb. 2 (unten) Ergebnisse der multivariaten Analyse von MS-Daten durch eMSTAT-Solution | Links: iPS-Zellen, rechts: Kulturüberstand