Vollautomatisches forensisches Screening von getrockneten Blutspots mit MRM Spectrum Mode
Die zunehmende Menge an verschreibungspflichtigen und illegalen Drogen zwingt klinische Labore dazu, kosteneffektivere und schnellere Screening-Methoden für Drogentests am Arbeitsplatz, für Tests am Straßenrand, für Rehabilitationsprogramme oder Post-Mortem-Untersuchungen zu entwickeln, ohne dabei die etablierten falsch-positiven oder negativen Nachweisraten zu gefährden. Daher muss die steigende Probenmenge mit einem großen Panel von Analyten in kürzerer Analysezeit und mit einfachen Probenvorbereitungsschritten verarbeitet werden. In dieser Studie stellen wir ein vollautomatisches Extraktionsverfahren für getrocknete Blutspots (DBS) vor, das mit einem LC-MS/MS-System für das forensische und toxikologische Screening von Drogen und deren Metaboliten gekoppelt ist. Wir verwenden einen neuen Ansatz, den MRM Spectrum Mode, indem wir mindestens 5 MRM-Übergänge jeder Verbindung messen, um eine hohe Kondensation für die Identifizierung der Ergebnisse zu erzeugen.

Abbildung 1: Instrumenteller Aufbau: DBS-MS 500 (CAMAG, Schweiz), Nexera X2 UHPLC (Shimadzu, Japan), LCMS-8060 (Shimadzu, Japan)
Methoden
Das DBS-MS 500 System (CAMAG, Schweiz) wurde als Frontend an ein modulares Nexera X2 UHPLC-System von Shimadzu (Kyoto, Japan) angeschlossen. Die Analyse wurde im positiven Multiple Reaction Monitoring (MRM)-Modus auf den ESI-Tandem-Massenspektrometriesystemen LCMS-8040 und LCMS-8060 (Shimadzu, Kyoto) durchgeführt. Die Dateninterpretation wurde mit der Software LabSolutions Insight Screening durchgeführt. Analytische Standards wurden von Lipomed (Schweiz) bezogen. DBS-Karten (Ahlstrom TFN lter Papier) wurden von CAMAG (Muttenz, Schweiz) zur Verfügung gestellt. Die Chromatographie wurde auf den analytischen Säulen Shim-pack GIST (2,1 x50 mm, 2 m C18) (GL Science, Japan) und Kinetex (2,1 x 100 mm, 2,6m, XB-C18) (Phenomenex, USA) unter Verwendung eines Gradienten von 10 mmol/L Ammoniumformiat + 0,1% Ameisensäure in Wasser und Methanol als mobile Phasen A und B durchgeführt.
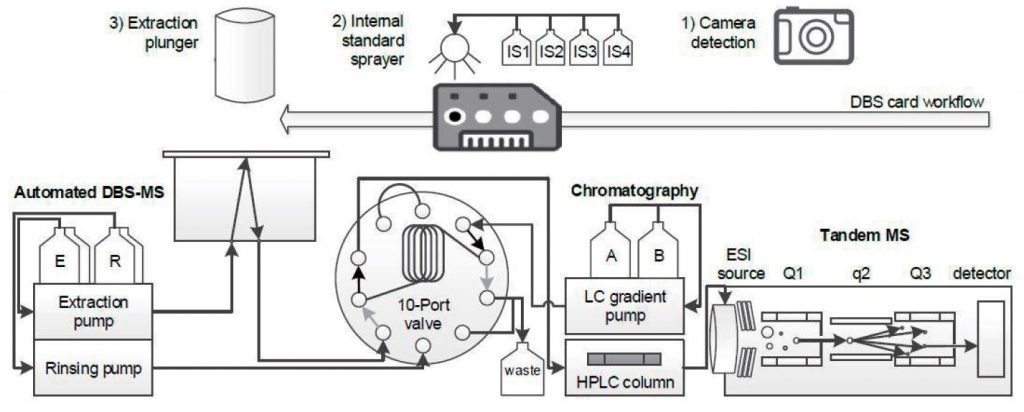
Abbildung 2: Vollautomatischer Arbeitsablauf für das DBS-MS 500
Ergebnisse des Vergleichs von DDA und MRM Spectrum Mode
Der klassische Ansatz zur Identifizierung in Routine-Wirkstoffscreening-Workflows basiert auf der datenabhängigen Akquisition (DDA). Nachdem ein bestimmter Schwellenwert eines bestimmten MRM-Übergangs überschritten wurde, erfasst das MS automatisch drei Produktionenscans (PIS) auf verschiedenen CE-Ebenen. Diese Spektren werden fusioniert und mit einer Bibliothek verglichen. Der neuartige Ansatz ist die Erfassung von mindestens zwei MRM-Übergängen pro Verbindung, die ebenfalls zu einem Spektrum (MRM-Spektrum) zusammengeführt und mit den entsprechenden Bibliothekseinträgen verglichen werden. Alle MRM-Übergänge werden mit dem in der LabSolutions Software (Shimadzu, Kyoto) implementierten Tool zur automatischen Methodenoptimierung optimiert. Selbst bei niedrigen Konzentrationen werden mit dem MRM Spectrum Mode hohe Übereinstimmungen zwischen experimentellen und Referenzspektren erzielt, was zu einem besseren Ähnlichkeitsindex (SI) führt. Auch die Einschaltdauer wurde mit diesem Ansatz reduziert.
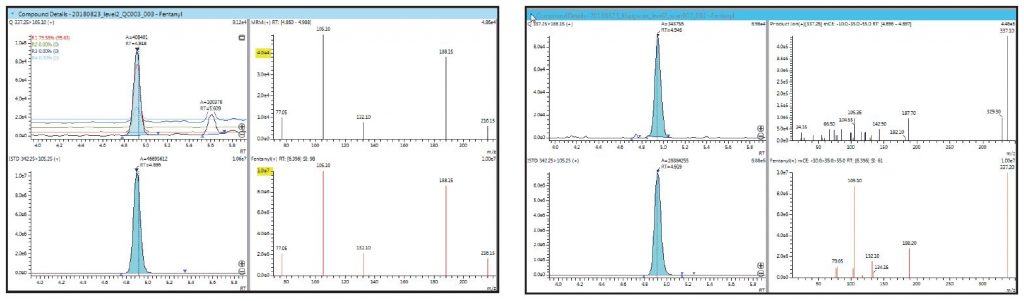
Abbildung 3: Vergleich von MRM-Spektrenmodus und Produktionenscan (DDA)
MRM-Spektrum (schwarz) von 5 ng/ml Fentanyl in Vollblut im
Vergleich zu seinem Referenzspektrum (rot) SI = 98; Zykluszeit = 30 ms
Produktionenspektrum (schwarz) von 5 ng/ml Fentanyl in Vollblut im
Vergleich zu seinem Referenzspektrum (rot) SI = 61; Zykluszeit = 95 ms
Korrelation und Präzision
Die Kalibrierwerte wurden an zwei verschiedenen Tagen 6-fach gemessen, um die Robustheit und Validität der Methode zu bestimmen. Die relative Standardabweichung des internen Standards lag für alle Zielverbindungen unter 15 %, indem die Daten über alle Stufen (5-1000 ng/mL) verglichen wurden. Die Korrelation und die Schwankungen zwischen den Tagen für alle Zielverbindungen sind in Tabelle 1 aufgeführt. Das Verhältnis von Zielsubstanz zu internem Standard wurde zum Vergleich der Ergebnisse und zur Entwicklung der Kalibrierungslinie verwendet. Für alle Zielsubstanzen wurde eine ausgezeichnete Korrelation erzielt. Alle Punkte der Kalibrierfunktionen waren hinreichend genau mit relativen Standardabweichungen unter 15 % bzw. 20 % bei LOQ. THCA-A, 6-MAM und Diazepam bilden eine Ausnahme, die weiter untersucht und validiert werden muss. Tabelle 1 enthält auch die Cut-off- und toxikologischen Werte aus der Literatur für Blutproben. Ziel der Analysemethode war es, die Cut-Off-Konzentration kondensiert nachzuweisen.
Tabelle 1: Relative Inter-Tages-Standardabweichung für 27 Zielsubstanzen bei verschiedenen Konzentrationen; Korrelationskoeffizienten (R²) der linearen t; Cut-off und toxikologische Werte
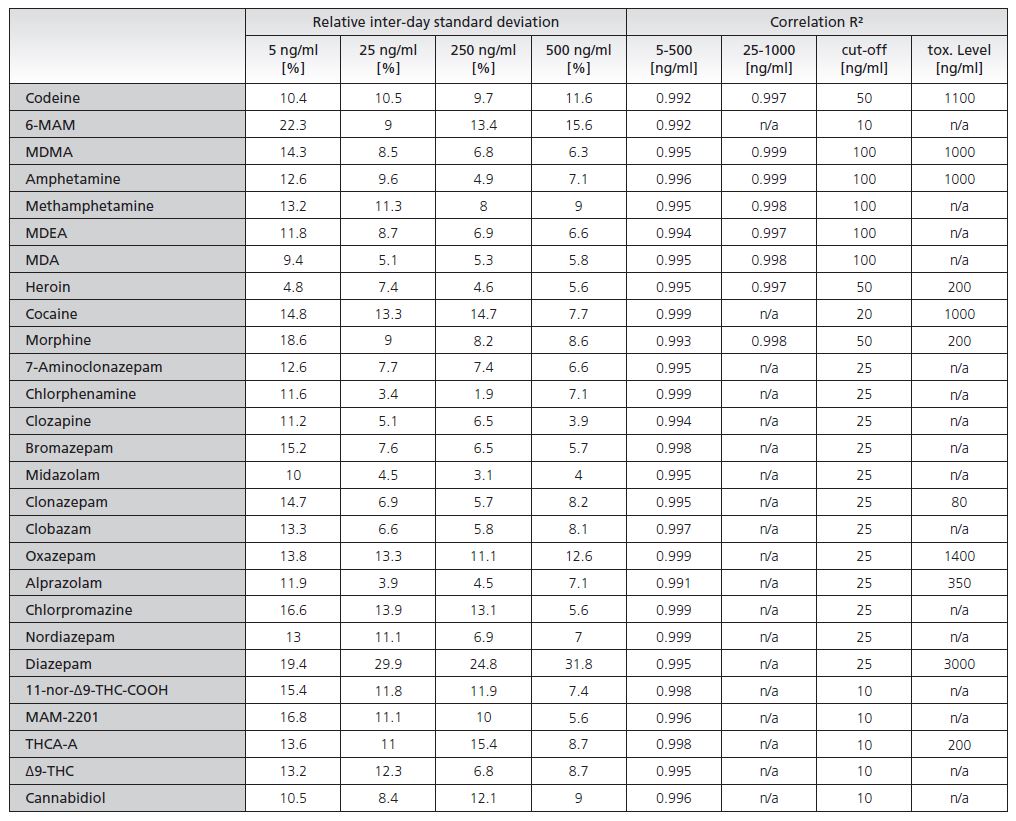
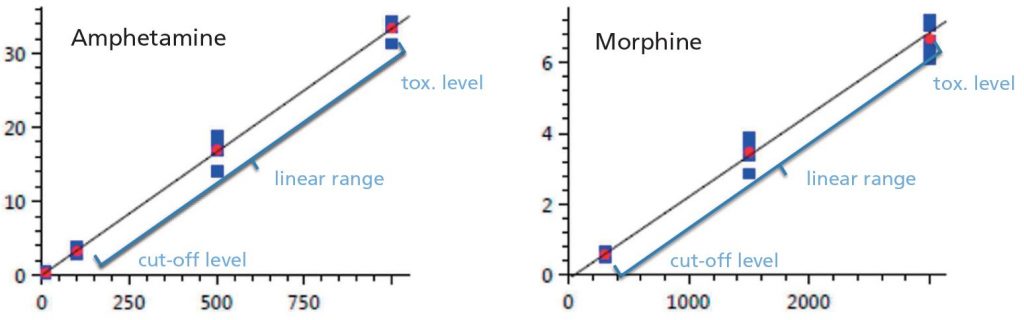
Abbildung 4: Repräsentative Kalibrierkurven (Amphetamin und Morphin; Kurventyp: linear; Nullpunkt: nicht erzwungen; Gewichtung: 1/C²; quant. Methode: interner Standard)
Qualitätskontrollkarten und interne Standards
Vor der Analyse wurden hohe und niedrige Kontrollproben gemessen. Die niedrige Kontrolle gibt eine Konzentration nahe dem Cut-off der THC-Derivate wieder und die hohe Kontrolle gibt einen deutlich höheren Wert an, um die Analyseleistung zu kontrollieren. Die Kontrollkarten wurden vom Labor unter Verwendung des DBS-MS 500 Sprühmoduls vorbereitet. 10 l des deuterierten Alprazolam- oder Kokainstandards werden als 0,1 g/mL Lösung in Methanol direkt auf das DBS vor der Extraktion gesprüht. Die interne Standardlösung kann bis zu zwei Wochen verwendet werden, wenn sie über Nacht im Kühlschrank aufbewahrt wird. In der Phase der Methodenentwicklung wurde Alprazolam-D5 und bei der Methodenimplementierung aufgrund der Standardverfügbarkeit Kokain-D3 verwendet.

Methodentransfer zum Routine-Labor
Die beschriebene Methode wurde in einem Forschungslabor mit einem Shimadzu LCMS-8060 System entwickelt und anschließend in ein Routinelabor übertragen, das mit einem LCMS-8040 ausgestattet ist. Nach dem Transfer der Methode und der Anpassung der MRM-Spannungen der Zielsubstanzen durch das LabSolutions-Optimierungstool wurde eine Ve-Punkt-Kalibrierung mit jeweils drei Wiederholungen im Bereich von 10 bis 500 ng/mL Zielsubstanz im Blut gemessen, da dies der für das Routinelabor interessante Bereich war. Vorbesprühte Qualitätskontrollproben wurden vor und nach den Kalibrierungsproben nach dem beschriebenen Ablauf gemessen. Eine ausgezeichnete Korrelation >0,995 und eine Standardabweichung unter 15 % wurde für alle Verbindungen erzielt, außer für die THC-Derivate, bei denen die Korrelation über 0,985 und die Standardabweichung unter 25 % lag. Die Sensitivität der THC-Derivate ist auf dem 8040 LCMS-System am Limit, jedoch kann das Ergebnis zuverlässig detektiert werden, wenn der Cut-off bei 25 ng/mL statt bei 10 ng/mL gesetzt wird.
Fazit
– Eine schnelle Screening-Methode (5 min pro Probe) von getrockneten Blutkonserven wurde für 28 häufig vorkommende illegale Drogen entwickelt – Die Methode wurde auf 20 min erweitert, was die Nutzung einer forensischen Toxikologie-Datenbank zum Screening von über 1200 Drogen ermöglicht
– Der MRM Spectrum Mode bietet eine höhere Dichte der Ergebnisse und reduziert falsch-positive und -negative Ergebnisse durch bessere spektrale Qualität, keine Notwendigkeit einer Intensitätsschwelle und schnellere Zykluszeiten
– Die Drogenscreening-Methode wurde erfolgreich in ein Routinelabor übertragen und zeigt eine gute Korrelation und Präzision
Davor Fielitz(1), Stefan Gaugler(2), Jana Rykl(3), Maha Khalid Almazraoua(4), Matthias Grill(5), Vincente L. Cebolla(6), Asem Quanair(7)
(1) Shimadzu Deutschland, Germany;
(2) CAMAG, Switzerland;
(3) Shimadzu Schweiz, Switzerland;
(4) The Regional Poison Control Center Dammam,
Saudi Arabia;
(5) Lipomed, Switzerland;
(6) Instituto de Carboquímica, Spain;
(7) Analytica One, Bahrain
Disclaimer: For Research Use Only. Not for use in diagnostic procedures. This presentation may contain references to products that are not available in your country. All rights reserved. Information subject to change without notice.