Trennung von Lipiden mit dem überkritischen Flüssigkeitschromatographen Nexera™ UC
Lipide werden oft als von lebenden Organismen abgeleitete Verbindungen bezeichnet, die sich in organischen Lösungsmitteln lösen. Dabei gibt es eine Vielzahl an unterschiedlicher Arten, darunter komplexe Lipide, die polare Gruppen wie Phosphatgruppen und Zucker in ihrer Struktur haben, und einfache Lipide wie Fettsäuren und Acylglycerin. Sie werden in Lipidklassen mit gemeinsamen funktionellen Gruppen in ihrer Struktur eingeteilt, wobei sich die physikalischen Eigenschaften je nach Klasse stark variieren. Es gibt auch verschiedene molekulare Spezies der konstituierenden Fettsäuren innerhalb derselben Lipidklasse. Daher ist für die Lipidanalyse eine hohe Trennkapazität erforderlich, und bei der HPLC werden der Normalphasenmodus und der Umkehrphasenmodus je nach Zweck unterschiedlich angewendet. Im Allgemeinen wird bei der Trennung in Lipidklassen der Normalphasenmodus und bei der Trennung von Molekülspezies der Umkehrphasenmodus verwendet. Die mobilen Phasen, die in den beiden Modi verwendet werden, sind völlig unterschiedlich, und es ist eine enorme Herausforderung, die Modi in einer Analyse zu wechseln. Hier stellen wir Trennungen durch überkritische Flüssigkeitschromatographie (SFC) unter Verwendung verschiedener Säulen mit unterschiedlichen stationären Phasen vor.
Zielkomponenten und Analysebedingungen
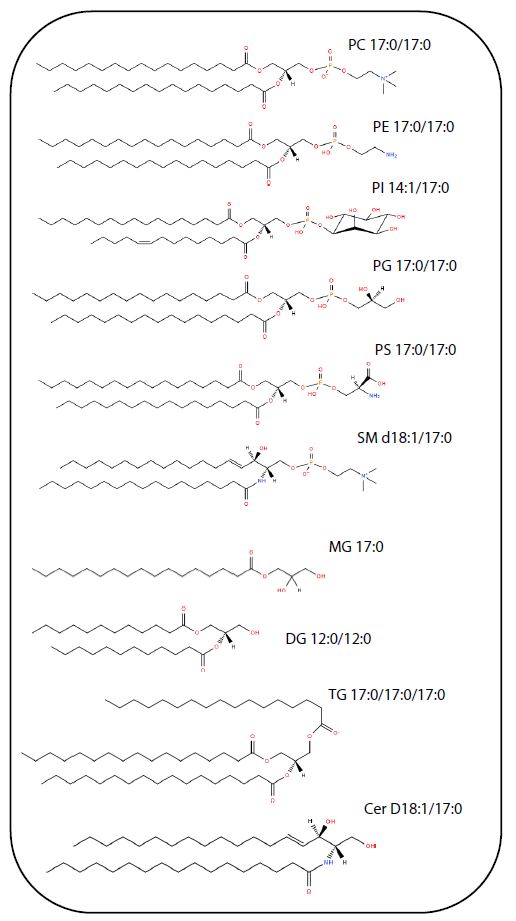
Die verschiedenen Lipidkomponenten der 10 in Tabelle 1 aufgeführten Lipidklassen wurden mit vier verschiedenen stationären Phasensäulen – Diol, Kieselgel und ODS, modifiziert mit polaren Gruppen – getrennt und das Retentionsverhalten überprüft. Die Strukturformeln für jedes der Lipide sind in Abb. 1 dargestellt. Die MRM-Bedingungen des Massenspektrometers und die Analysebedingungen für die SFC sind in Tabelle 1 und Tabelle 2 zusammengefasst. Abb. 2 bis Abb. 5 zeigen die Chromatogramme für Standardproben von 1 μmol/L.
| Standard | Konz. (μmol/L) | MRM-Übergang (positiv) | Modus |
|---|---|---|---|
| PC 17:0/17:0 | 1 | 762,60>184,00 | + |
| PE 17:0/17:0 | 1 | 720,55>579,55 | + |
| PI 14,1/17:0 | 0,5 | 811,95>534,95 | - |
| PG 17:0/17:0 | 1 | 768,50>579,40 | + |
| PS 17:0/17:0 | 1 | 764,50>579,40 | + |
| SM d18:1/17:0 | 1 | 717,60>184,00 | + |
| MG 17:0 | 1 | 362,30>327,30 | + |
| DG 12:0/12:0 | 1 | 474,40>439,40 | + |
| TG 17:0/17:0/17:0 | 1 | 866,80>579,50 | + |
| Cer d18:1/17:0 | 1 | 552,50>264,30 | + |
| Säule | (1) Shim-pack™ UC-Diol (2) Shim-pack™ UC-Sil (3) Shim-pack™ UC-GIS II (ODS) (4) Shim-pack™ UC-RP (Embedded-polar-group ODS) | 150 mm L; 2,1 mm LD; 3 μm |
| Mobile Phase | A: CO2 | B: 0,1 % (w/v) Ammoniumformiat in Methanol |
| Gradient | B.konz. 5 % (0 min) - 40 % (12-14 min) - 5 % (14,1-17 min) |
| Flussrate | 0,8 mL/min |
| Säulentemp. | 40°C |
| BPR-Druck | 10 MPa |
| Detektor | LCMS-8050 (ESI, MRM-Modus) |
| Zusammensetzung | 0,1 % (w/v) Ammoniumformiat in Methanol |
| Durchflussrate | 0,05 mL/min |
| Injektionsvolumen | 1 μL |
Chromatogramme
Aus Abb. 2 bis Abb. 5 ist ersichtlich, dass sich das Retentionsverhalten und die Peakform je nach Wahl in der stationären Phase stark unterscheiden. Diol und Kieselgel werden im Normalphasenmodus in der HPLC verwendet, und ihr Retentionsverhalten ist bei der SFC sehr ähnlich, aber Kieselgel kann spezifisch an der stationären Phase adsorbiert werden. ODS und ODS mit eingebetteter polarer Gruppe werden im Umkehrphasenmodus in der HPLC verwendet, und die Retentionszeit nimmt tendenziell zu, wenn die Zielkomponente stark hydrophobe Eigenschaften aufweist. Es gibt einen ähnlichen Trend bei der SFC, aber wenn ein ODS mit eingebetteten polaren Gruppen verwendet wird, kann die Retention durch polare Basen manchmal wie in der normalen Phase stattfinden und nicht die Retention wie in der Umkehrphase unter Verwendung von ODS-Gruppen. In der stationären Phase für die Umkehrphase wie ODS werden Acylglycerine in der Reihenfolge MG > DG > TG eluiert, aber in der stationären Phase für die normale Phase wie Diol werden sie in der Reihenfolge TG > DG > MG eluiert; die Reihenfolge der Elution ist umgekehrt. Bei der SFC können also bei Verwendung der gleichen mobilen Phase verschiedene stationäre Phasen für die normale Phase und die Umkehrphase verwendet werden, um eine Vielzahl von Trennungen zu erzielen.
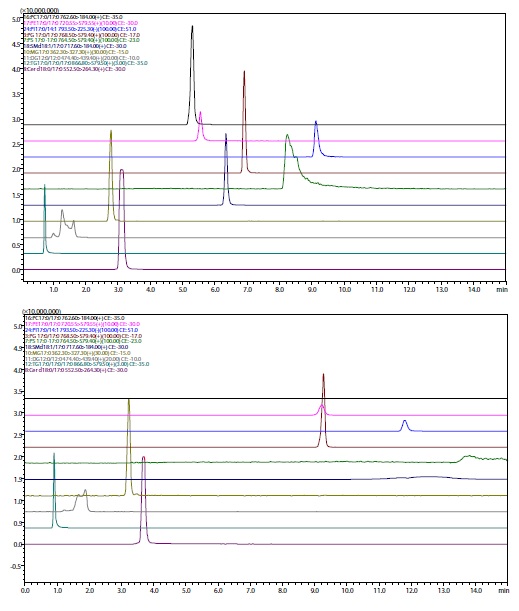
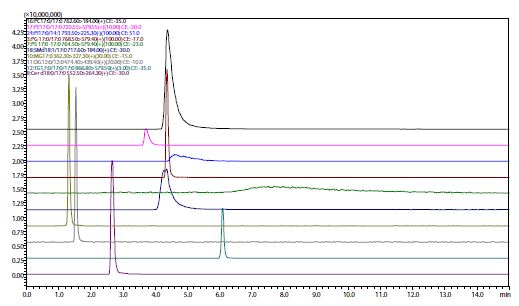
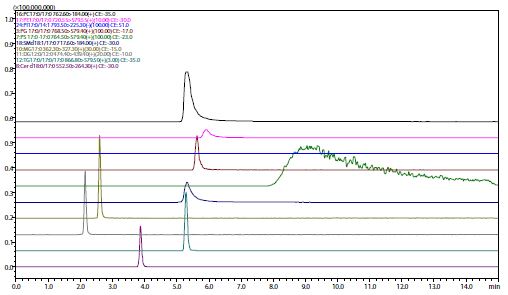
Abb. 4 (links) Chromatogramm mit einer stationären ODS-Phase
Abb. 5 (rechts) Chromatogramm mit einer stationären Phase eines ODS mit eingebetteter polarer Gruppe