Analyse toxischer chemischer Substanzen, die an Mikroplastik adsorbiert sind
Es wurde auf die Möglichkeit hingewiesen, dass toxische chemische Substanzen, die in der Umwelt an Mikroplastiken (MP) adsorbiert werden, das Ökosystem beeinflussen können, indem sie von den MP desorbieren, in die Körper lebender Organismen wandern und sich in diesen Organismen anreichern.
Die Shimadzu-Gruppe war durch die Analyse von MP an der Bewertung von Adsorptionseigenschaften chemischer Substanzen an Mikroplastiken beteiligt* **.
Im folgenden Artikel stellen wir ein Beispiel für die Bewertung der Adsorptionseigenschaften von MP an polyzyklischen Kohlenwasserstoffen (PAKs) und Per- und Polyfluoralkyl-Substanzen vor, von denen bekannt ist, dass sie toxische und bioakkumulierende Eigenschaften haben. Unter Verwendung von handelsüblichem partikelförmigem Polypropylen (PP), Polystyrol (PS) und Polyethylen (PE) als MP-Proben wurde die Menge der Adsorption von PAKs und PFAS in Wasser auf den verschiedenen Kunststoffen quantitativ durch GC-MS/MS und LC-MS/MS analysiert.

Die folgenden drei Arten von Kunststoffpartikeln wurden als Proben für die MP verwendet.
1) Polypropylen (PP)
2) Polystyrol (PS)
3) Polyethylen (PE)
Zu Beginn wurden die langen und kurzen Durchmesser der einzelnen Partikelarten anhand von stereoskopischen Mikroskopaufnahmen berechnet und geprüft, ob die Größe dieser Materialien weniger als 5 mm betragen, was der Definition von MP entspricht. Tabelle 1 zeigt das Aussehen und die mikroskopischen Bilder der oben erwähnten Kunststoffpartikel 1) bis 3), zusammen mit der durchschnittlichen Größe von 10 zufällig entnommenen Partikeln. Bei den Messungen wurden die folgenden Instrumente verwendet.
– Mikroskop-Digitalkamera-System : Moticam 1080
– Stereoskopisches Mikroskop : STZ-171-TP
Testmethode
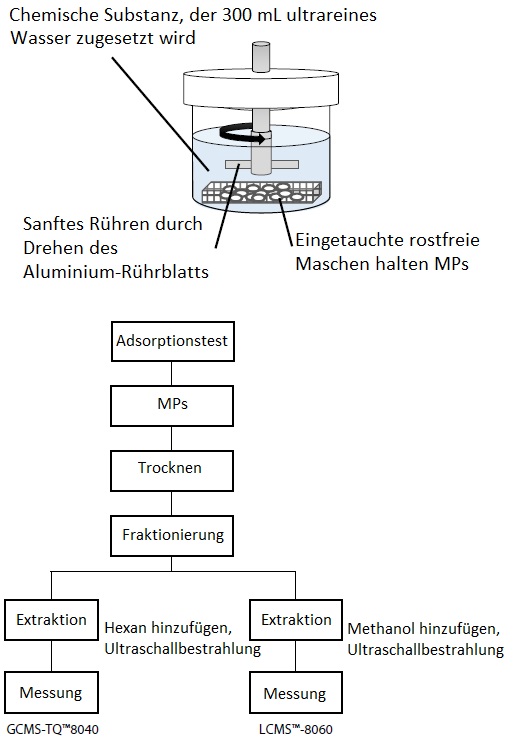
Zunächst wurde ein Adsorptionstest von PAK und PFAS an den MP-Proben durchgeführt. Abb. 1 zeigt eine Skizze des Adsorptionstestsystems. Die MP-Proben wurden in Wasser getaucht, dem PAK oder PFAS zugegeben worden waren, und das MP-Wasser-Gemisch wurde 24 Stunden lang vorsichtig gerührt, um die Adsorption zu fördern. Die den MP zugesetzten Mengen betrugen 100 ng PAK und 8 ng PFAS in 300 mL Reinstwasser.
Abb. 2 zeigt einen Überblick über den Testablauf. Nach dem Adsorptionstest wurden die MPs aus dem Testsystem entfernt und getrocknet. Bei einem Teil der Proben wurde die Ultraschallextraktion mit Hexan als Vorbehandlung für die PAKs und die Ultraschallextraktion mit Methanol als Vorbehandlung für die PFAS verwendet. Die hier gewonnenen Extrakte wurden zur quantitativen Analyse der PAK und PFAS in die GCMS/MS bzw. LC-MS/MS injiziert.
Messung von PAK durch GC-MS/MS
Die Messung der PAK fand unter Verwendung des GCMS-TQ8040 Triple-Quadrupol-Gaschromatographie-Massenspektrometer (Abb. 3) statt. Tabelle 2 zeigt die Messbedingungen des GCMS-TQ8040.
Die Messungen wurden im hochselektiven MRM-Modus durchgeführt. Basierend auf der Linearität der Kalibrierkurve und dem Peak-S/N-Verhältnis wurde die untere Grenze der Quantifizierung der Verbindungen mit 0,5 bis 2 ng/mL angenommen. Abb. 4 zeigt das MS-Chromatogramm der PAK-Standardlösung (je 2 ng/mL). Die quantitativen Berechnungen wurden mit der Methode des internen Standards durchgeführt.
Tabelle 2 GCMS-TQ8040 Messbedingungen
| GC | |||||
| Säule | DB-5ms (Agilent Technologies/J&W) (30 m × 0.25 mm I.D., 0.25 μm) | ||||
| Säulenofen-Temp.-Programm | 60 °C (1 min) – 15 °C/min – 200 °C (0 min) – 8 °C/min – 320 °C (10 min) | ||||
| Injektionsmodus | Splitlos | ||||
| Verdampfungskammer-Temp. | 300°C | ||||
| Injektionsvolumen | 2 μL | ||||
| Trägergas | Helium (1.0 mL/min) | ||||
| MS | |||||
| Ionisierungs-Methode | EI | ||||
| Ionisierungsspannung | 70 V | ||||
| Schnittstellen-Temp. | 300°C | ||||
| Messmodus | MRM | ||||
| Gemessene Ionen (m/z) | |||||
| Verbindung (Zielsubstanz) | Quantiatives Ion | Referenz-Ion | Verbindung (interner Standard) | Quantitatives Ion | Referenz-Ion |
| Naphthalin | 128>128 | 128>102 | Naphthalin-d8 | 136>136 | 136>108 |
| Acenaphthylen | 152>152 | 152>151 | Acenaphthylen-d8 | 160>160 | 160>158 |
| Acenaphthen | 153>153 | 153>152 | Acenaphthen-d10 | 162>162 | 162>160 |
| Fluoren | 165>165 | 165>164 | Fluoren-d10 | 174>174 | 174>171 |
| Anthrazen | 178>178 | 178>152 | Anthrazen-d10 | 188>188 | 188>160 |
| Phenanthren | 178>178 | 178>152 | Phenanthren-d10 | 188>188 | 188>160 |
| Fluoranthen | 202>202 | 202>200 | Fluoranthen-d10 | 212>212 | 212>208 |
| Pyrene | 202>202 | 202>200 | Pyrene-d10 | 212>208 | 212>208 |
| Benz[a]anthracen | 228>228 | 228>226 | Benz[a]anthracen-d12 | 240>240 | 240>236 |
| Chrysene | 228>228 | 228>226 | Chrysene-d12 | 240>240 | 240>236 |
| Benzo[b]fluoranthen | 252>252 | 252>250 | Benzo[b]fluoranthen-d12 | 264>264 | 264>260 |
| Benzo[k]fluoranthen | 252>252 | 252>250 | Benzo[k]fluoranthen-d12 | 264>264 | 264>236 |
| Benzo[a]pyren | 252>252 | 252>250 | Benzo[a]pyren-d12 | 264>264 | 264>260 |
| Benzo[ghi]perylen | 276>276 | 276>274 | Benzo[ghi]perylen-d12 | 288>288 | 288>284 |
| Indeno[1,2,3-cd]pyren | 276>276 | 276>274 | Indeno[1,2,3-cd]pyren-d12 | 288>288 | 288>284 |
| Dibenzo[a,h]anthracen | 278>278 | 278>276 | Dibenzo[a,h]anthracen-d14 | 292>292 | 292>288 |
| Hexachlorbenzol-13C6 | 292>292 | 292>292 |
Abb. 4 MRM-Chromatogramm der PAK-Standardlösung (je 2 ng/mL) (nur Zielsubstanzen)
Messung von PFAS durch LC-MS/MS
Das für die Messungen der PFAS verwendete Instrument war ein LCMS-8060 Triple-Quadrupol-Flüssigkeitschromatographie-Massenspektrometer (Abb. 5). Tabelle 3 zeigt die Messbedingungen.
Die Messungen wurden im hochselektiven MRM-Modus durchgeführt. Basierend auf der Linearität der Kalibrierkurve und dem Peak-S/N-Verhältnis wurde die untere Grenze der Quantifizierung der Verbindungen mit 0,01 bis 0,5 ng/mL angenommen. Abb. 6 zeigt das MS-Chromatogramm der PFAS-Standardlösung (jeweils 0,5 ng/mL). Die quantitativen Berechnungen wurden mit der Methode des internen Standards durchgeführt.
Tabelle 3 LCMS-8060 Messbedingungen
| LC | |||||
| Säule | Inertsil ODS-SP (GL Sciences) (150 mm × 2.1 mm I.D., 3 μm) | ||||
| Säulentemp. | 40°C | ||||
| Injektionsvolumen | 10 μL | ||||
| Mobile Phase A | 10 mmol/L Ammoniumacetat wässrige Lösung | ||||
| Mobile Phase B | Acetonitril | ||||
| Mobile Phase Flussrate | 0,2 mL/min | ||||
| Gradient | B konz. 0% (0 min) → 10% (1 min) → 40% (7 min) → 95% (31-38 min) → 10% (47 min) | ||||
| MS | |||||
| Ionisierungs-Methode | ESI | ||||
| Polarität | Negativ | ||||
| Messmodus | MRM | ||||
| MRM-Übergang | |||||
| Verbindung (Zielsubstanz) | Quantitatives Ion | Referenz-Ion | Verbindung (interner Standard) | Quantitatives Ion | Referenz-Ion |
| PFHxA | 313>269 | 313>119 | PFHxA-13C5 | 318>273 | 318>121 |
| PFHpA | 363>319 | 363>169 | PFHpA-13C4 | 367>322 | 367>169 |
| PFOA | 413>369 | 413>169 | PFOA-13C8 | 421>376 | 421>172 |
| PFNA | 463>419 | 463>219 | PFNA-13C9 | 472>427 | 472>223 |
| PFDA | 513>469 | 513>219 | PFDA-13C6 | 519>474 | 519>219 |
| PFUnDA | 563>519 | 563>269 | PFUnDA-13C7 | 570>525 | 570>274 |
| PFDoDA | 613>569 | 613>269 | PFDoDA-13C2 | 615>570 | 615>169 |
| PFTrDA | 663>619 | 663>169 | |||
| PFTeDA | 713>669 | 713>169 | PFTeDA-13C2 | 715>670 | 715>169 |
| PFHxDA | 813>769 | 813>169 | PFHxDA-13C2 | 815>770 | 815>169 |
| PFOcDA | 913>869 | 913>169 | |||
| PFBS | 299>80 | 299>99 | PFBS-13C3 | 302>80 | 302>99 |
| PFPeS | 349>80 | 349>99 | |||
| PFHxS | 399>80 | 399>99 | PFHxS-13C3 | 402>80 | 402>99 |
| PFHpS | 449>80 | 449>99 | |||
| PFOS | 499>80 | 499>99 | PFOS-13C8 | 507>80 | 507>99 |
| PFNS | 549>80 | 549>99 | |||
| PFDS | 599>80 | 599>99 | |||
| PFDoS | 699>80 | 699>99 |
Abb. 6 MRM-Chromatogramm der PFAS-Standardlösung (jeweils 0,5 ng/mL) (Nur Zielsubstanzen)
Messergebnisse
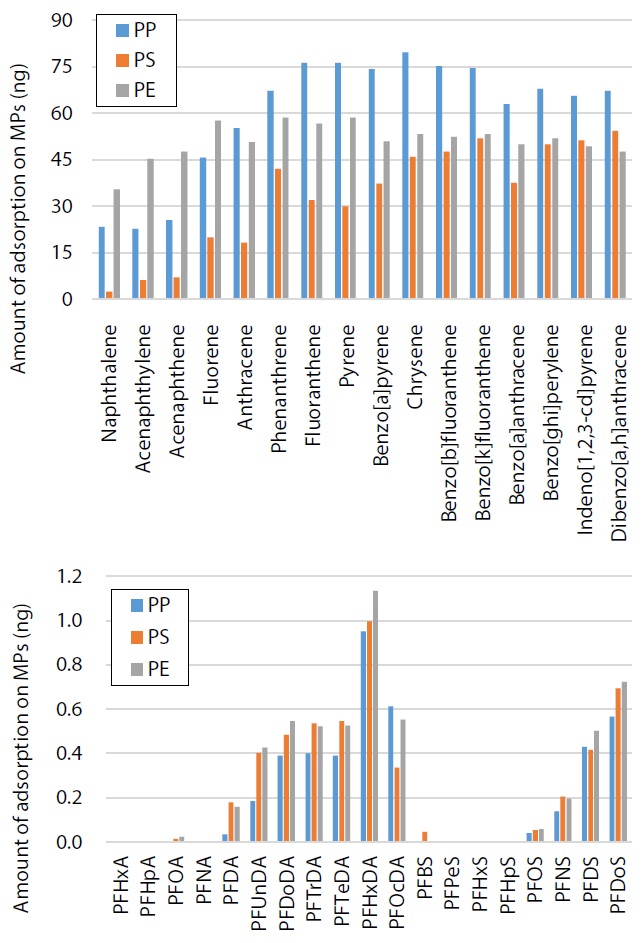
Abb. 7 zeigt die Ergebnisse der Analyse der PAK durch GCMS/MS, und Abb. 8 zeigt die Ergebnisse der Analyse der PFAS durch LC-MS/MS. Die Adsorption an den MP wurde für alle PAK-Stoffe und für einige PFAS-Stoffe bestätigt. Die Adsorption der PAK an PP und PP waren tendenziell groß, jedoch die Adsorptionsmenge der PFAS waren für jede chemische Substanz unterschiedlich. Da die Adsorptionseigenschaften an MP je nach chemischer Substanz variieren, kann man aufgrund der Ergebnisse erwarten, dass einige leicht das das MP-Material, d.h. seine Molekularstruktur, beeinflusst werden und andere nicht.
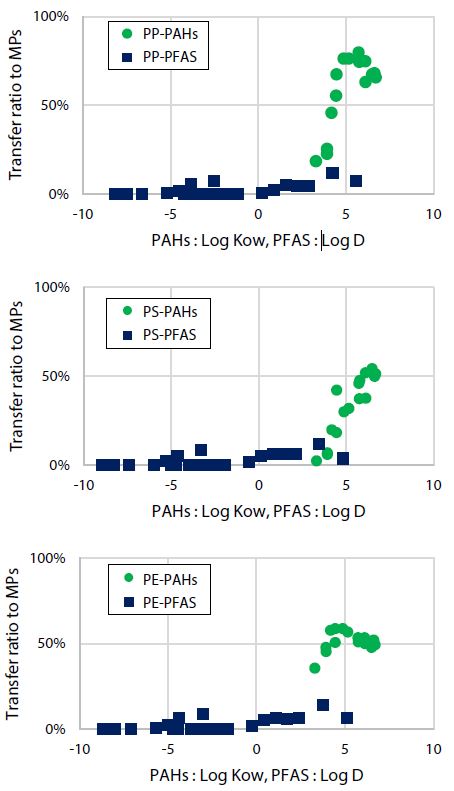
Es wird davon ausgegangen, dass die Adsorption von chemischen Substanzen an MP hauptsächlich von ihrer hydrophoben Wechselwirkung abhängt. Deshalb untersuchten wir die Korrelation zwischen Log Kow (*1) und Log D (*2), welche die Hydrophobie chemischer Substanzen zeigen, und dem Übertragungsverhältnis chemischer Substanzen auf MP. Das Transferverhältnis zu dem Mikroplastik wurde definiert als der Wert, der durch Division der an dem Mikroplastik adsorbierten Menge an PHAs oder PFAS durch die Menge dieser Substanzen, die dem Wasser zugesetzt wird, erhalten wird. Abb. 9 zeigt die Beziehung zwischen der Hydrophobie der chemischen Substanzen und dem Transferverhältnis zu den MP. In der Reihenfolge von oben zeigt diese Abbildung die Übertragungsverhältnisse zu PP, PS und PE. Bei diesen Ergebnissen zeigte sich eine Tendenz zur Erhöhung des Übertragungsverhältnisses mit höheren Werten von Log Kow und Log D, unabhängig von der Art der MPs.
(*1) Log Kow : Oktanol/Wasser-Verteilungskoeffizient
(*2) Log D : Log Kow ist ein Verteilungskoeffizient einer chemischen Substanz, der den Einfluss der elektrolytischen Dissoziation (Ionisierung) in Wasser berücksichtigt. Hier wurde dieser Koeffizient für Wasser mit einem pH-Wert von 6,4 zum Zeitpunkt der Prüfung berechnet.
Fazit
Um die Adsorptionseigenschaften chemischer Substanzen an MP zu klären, wurde die Menge der Adsorption von PAKs und PFAS an MPs in Wasser quantitativ mit Hilfe von GC-MS/MS und LC-MS/MS überprüft.
Es stellte sich heraus, dass die Adsorptionseigenschaften an MPs für jede chemische Substanz unterschiedlich waren. Darüber hinaus konnte auf die Hydrophobie der einzelnen chemischen Substanzen als kritischer Faktor für ihre Übertragungsverhältnis geschlossen werden.
Referenzen
(1) Makoto Yasojima, Haruna Mizuka, Takaki Mine, Hiroaki Takemori, Shinji Takeuchi, Yoshihide Yasui, “Adsorption Characteristics of Chemical Substances on Microplastics,” Proceedings of the 22nd Symposium of the Japan Society on Water Environment (2019)
(2) Makoto Yasojima, Haruna Mizuka, Takaki Mine, Hiroaki Takemori, “Existence of Unknown Chemical Substances Adsorbed on Microplastics Immersed in Rivers and Adsorption Characteristics of Chemical Substances on Microplastics,” Proceedings of the 56th Environmental Engineering Research Forum (2019)