Analyse chemisch modifizierter Antikörper
Antikörper-Arzneimittel-Konjugate (ADC) sind spezielle Pharmazeutika, die aus einem an Antikörper gebundenen Medikament bestehen. In den 2000er Jahren stiegen die Erwartungen, dass durch diese Kombination der hohen Selektivität des Antikörpers und der Verfügbarkeit eines niedermolekularen Arzneimittels als wirksamere Krebsmedikamente dienen würden als frühere niedermolekulare Arzneimittel. Bei einer kleinen Anzahl von Produkten, die bereits auf dem Markt erhältlich sind, ist der Grad, wo und wie die Bindung stattfindet, ein wichtiges Merkmal zur Bestimmung der Qualität, wenn Verbindungen künstlich an Proteine gebunden werden. Wie im Fall der ADCs.
In diesem Artikel wird ein Beispiel für die Analyse des Pseudo-ADCs vorgestellt, bei dem eine künstliche Bindung niedermolekularer Verbindungen an einen Standard-Antikörper generiert wurde. Die massenspektrometrische Analyse wurde an einem linearen benchtop MALDI-TOF MS durchgeführt.
Massenspektrometrie eines mit einer niedermolekularen Verbindung modifizierten Antikörpers in nicht-reduzierter Form
Unter Verwendung der Methode von Seki et al. 1) wurden sowohl ein mit Me-Fluorescein-ABNO modifizierter Standard-Antikörper am Tryptophanrest (Abb.1, NISTmab, humanisiertes IgG κ monoklonal Antikörper, RM8671) als auch ein unbehandelten Standard-Antikörper (jeweils 0,5 µl) mit einem gleichen Volumen Matrixlösung gemischt (10 mg/mL Sinapinsäure in 50 % Acetonitril und 0,1 % Trifluoressigsäure) und anschließend auf dem MALDI Probentarget aufgebracht. Für die Analyse wurde das „MALDI-8020“ Benchtop-MALDI-TOF MS (Abb. 2) verwendet.

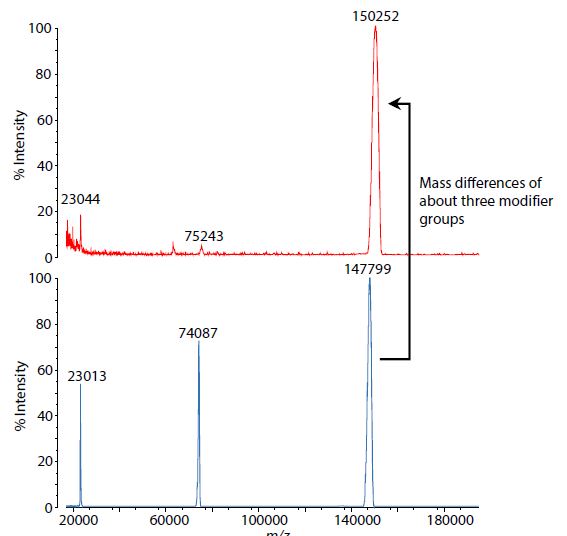
Abb. 3 zeigt einen Vergleich der MS-Spektren des modifizierten Antikörpers und des unbehandelten Antikörpers in nicht reduzierter Form. Im Spektrum der Probe des modifizierten Antikörpers konnte ein gegenüber dem unbehandelten Antikörper ein Signal festgestellt werden, welches Massenunterschiede von etwa drei Modifikatorgruppen entspricht.
Massenspektrometrie von Antikörpern nach Reduktionsbehandlung
Sowohl dem modifizierten Antikörper als auch dem unbehandelten Antikörper (je 4 μL) wurden 50 mM DTT-Wasserlösung (1 μL) zugesetzt, und anschließend wurde eine einstündige Reduktionsbehandlung bei 57 °C durchgeführt. Jede Reaktionslösung (0,5 μL) wurde dann mit 0,5 µl Matrixlösung (10 mg/mL Sinapinsäure in 50 % Acetonitril und 0,1 % Trifluoressigsäure) auf das MALDI-Probentarget aufgetragen, um schließlich die massenspektrometrische Analyse durchzuführen.
Die erhaltenen Ergebnisse (Abb. 4) zeigten keine Veränderung des modifizierten Antikörpers oder des unbehandelten Antikörpers in Bezug auf die leichten Ketten (m/z ~23.160). In Bezug auf die schweren Ketten (m/z ~51.000 & ~52.000) wurde jedoch für den modifizierten Antikörper im Vergleich zum Signal des unbehandelten Antikörpers ein Signal nachgewiesen, das eine Massenverschiebung von einer Modifikatorgruppe und zwei Modifikatorgruppen anzeigte.
Die in Abb. 3 & 4 gezeigten Ergebnisse zeigen dies für den in diesem Experiment verwendeten modifizierten Antikörper: (1) die Zugabe von drei Me-Fluorescein-ABNO-Gruppen war am produktivsten, (ii) die chemische Modifikation kommt nur an der schweren Ketten des Antikörpers vor, und darüber hinaus (iii) traten die Modifikationen nur an einer Stelle der einen schweren Kette und an zwei Stellen der anderen auf (Abb. 5).
Während es insgesamt 22 Tryptophanreste gab, bei denen Mefluorescein-ABNO potenziell an den in diesem Experiment verwendeten Standard-Antikörper binden konnte, waren Moleküle des Antikörpers mit nur den modifizierten Tryptophanresten die am häufigsten nachgewiesenen Spezies. Dies ist wahrscheinlich auf die sterische Konfiguration des Antikörpers zurückzuführen, die den Zugang von Mefluorescein-ABNO einschränkt.
Ein Hauptmerkmal des „MALDI-8020“ Tischgerätes MALDI-TOF MS ist die schnelle Probenzuführung, die es dem Anwender ermöglicht, die Analyse wenige Minuten nach der Probenzuführung zu beginnen, was zu einer erhöhten Produktivität führt. Wir haben am Beispiel eines modifizierten monoklonalen Antikörpers gezeigt, wie mit dem „MALDI-8020“ der Grad der Modifikation kleiner Moleküle schnell und bequem bestimmt werden kann.
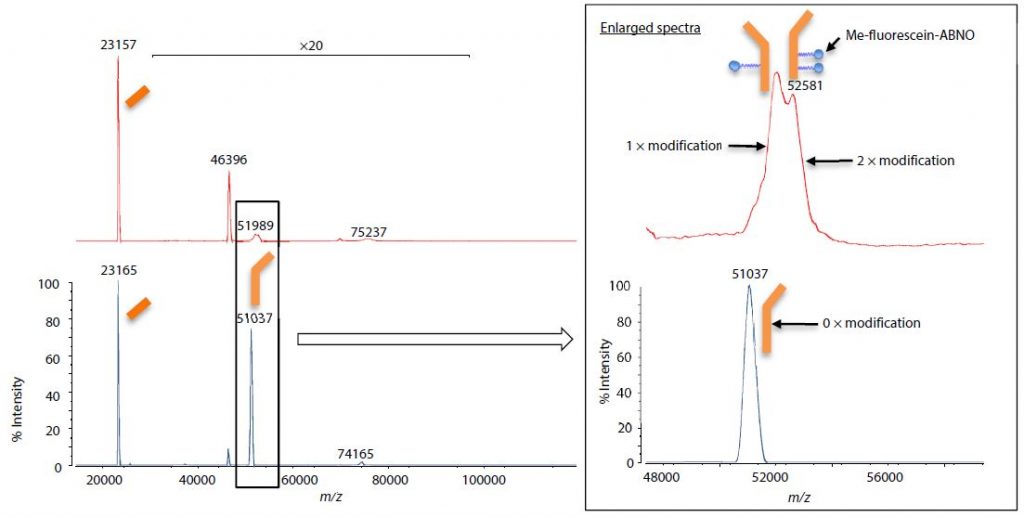
Abb. 4 Massenspektren des modifizierten Antikörpers (oben) und des unbehandelten Antikörpers (unten) nach der Reduktionsbehandlung
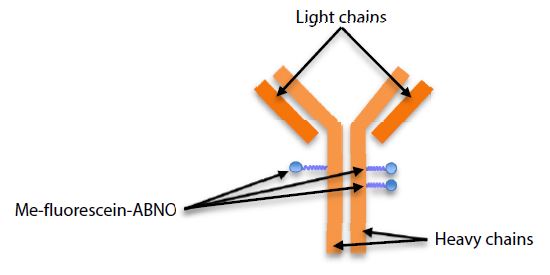
Abb. 5 Diagramm des modifizierten Antikörpers, der in dieser Analyse als Hauptbestandteil vermutet wird
Referenzen
1) Yohei Seki, Takashi Ishiyama, Daisuke Sasaki, Junpei Abe, Youhei Sohma, Kounosuke Oisaki, and Motomu Kanai: Transition Metal-Free Tryptophan-Selective Bioconjugation of Proteins. J. Am. Chem. Soc. 2016, 138 (34), 10798-801