Proteinanalyse mit FTIR: Analyse der durch thermische Denaturierung verursachten Veränderungen der Sekundärstrukturen in Eiklarproteinen
Die Applikationsnote beschreibt die Anwendung der Kurvenanpassung zur Analyse der Sekundärstrukturen von Rinderserumalbumin (BSA). Dieser Artikel beschreibt die Untersuchung der Veränderungen, die in den Sekundärstrukturen von Proteinen durch thermische Denaturierung auftreten. Die Veränderungen wurden auf der Grundlage der zweiten Ableitung und der Kurvenanpassung der Spektren untersucht, die gemessen wurden, als proteinhaltiges Eiweiß im Übermaß mit Hilfe eines beheizbaren ATR-Zubehörs mit drei Reflexionen von 40 auf 100 °C erhitzt wurde.
Probenvorbereitung
Eiklar wurde vom Dotter getrennt, so dass nur Eiklar analysiert wurde. Das Hauptprotein im Eiklar ist Ovalbumin, aber auch verschiedene andere Proteine wie Ovotransferrin und Ovomucoid sind enthalten.* In diesem Fall wurde das Eiklar ohne Trennung in die jeweiligen Komponenten gemessen.
Messung von Eiklar / Eiweiß
Eiklar wurde mit einem MicromATRTM ATR-Messzubehör gemessen, das mit einem beheizbaren ATR-Kristall mit drei Reflexionen (Diamant/ZnSe) ausgestattet ist. Da Eiweiß beim Erhitzen erstarrte, wurde ein ATR-Kristall mit drei Reflexionen verwendet, der auch für die Messung fester Proben verwendet werden konnte. Das optische System wurde mit trockener Luft gespült, um zu verhindern, dass sich die von Wasserveilchen stammenden Peaks im Amid I-Bereich überlappen.
Die Messbedingungen sind in Tabelle 1 aufgeführt. Unter Verwendung eines Temperaturreglers zur Erhöhung der Kristalltemperatur von 40 auf 100 °C in 10 °C-Schritten wurde eine ausreichende Wärmeübertragung auf das Eiweiß sichergestellt, indem nach dem Aufbringen der Tropfen zwei Minuten gewartet wurde, bevor die Proben bei den entsprechenden Temperaturen gemessen wurden. Da Eiklar viel Wasser enthält, müssen vor der Durchführung der Sekundärstrukturanalyse die Wasserabsorptionen vom Eiklar-Spektrum subtrahiert werden. Aufgrund der Temperaturabhängigkeit der Wasserstoffbrückenbindungen in Wasser wurden die Spektren von Wasser bei jeder Temperatur erhalten.
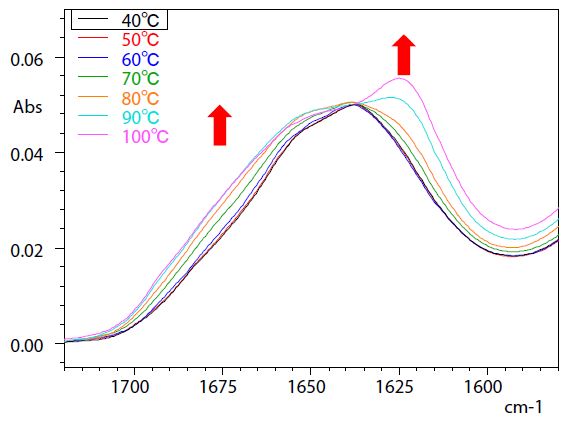
Abb. 1 zeigt die Spektren von Eiweiß nach Subtraktion der Absorptionen von Wasser bei jeder Temperatur. (Der Teil, der die Amid I-Bande in der Nähe von 1700 bis 1600 cm-1 einschließt, ist vergrößert dargestellt).
Es wurde berichtet, dass die Denaturierung von Proteinen beginnt, wenn Eiklar auf 60 °C erhitzt wird.** Abb. 1 zeigt, dass die Veränderungen bei 60 °C beginnen, wobei die Peaks nahe 1625 cm-1 und 1675 cm-1 deutlich zunehmen, was eine Korrelation mit der thermischen Denaturierung bestätigt.
Zweite abgeleitete Spektralanalyse
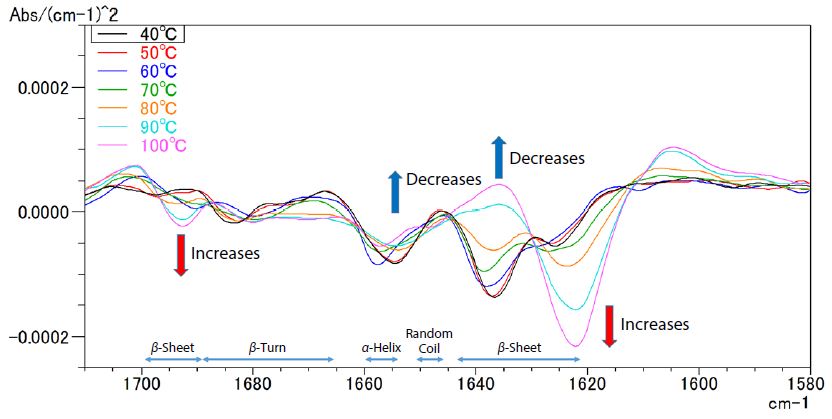
Leichte Variationen in der Form des Absorptionsspektrums lassen sich deutlicher zeigen, wenn man das Spektrum der zweiten Ableitung berechnet, das ideal für die Untersuchung von Veränderungen in Sekundärstrukturen von Proteinen ist (α-helix, β-sheet, β-turn, und random coil structures).
Abb. 2 zeigt die aus den Spektren in Abb. 1 berechneten Spektren der zweiten Ableitung für Eiweiß. Es zeigt, dass β-Blätter in der Nähe von 1693 cm-1 und 1622 cm-1 zunehmen, wenn das erhitzte Protein denaturiert wird, während die β-Blattstrukturen in der Nähe von 1637 cm-1 und α-Helixstrukturen in der Nähe von 1655 cm-1 abnehmen. Es zeigt auch, dass sich die Peaks aufgrund der thermischen Denaturierung verschoben haben, was darauf hindeutet, dass sich der Wasserstoffbindungsstatus geändert hat.
Kurvenanpassung im Amide-I-Band
Als nächstes wurde eine Kurvenanpassung für die Amid I-Bande durchgeführt, um die Veränderungen der Sekundärstrukturen aufgrund der thermischen Denaturierung quantitativ zu untersuchen. Für die Kurvenanpassung müssen zunächst einige Bedingungen wie die Wellenform und die Anzahl der für die Anpassung verwendeten Absorptionsbanden festgelegt werden. Die Anzahl der Banden wird durch ein zweites oder viertes abgeleitete Spektrum bestimmt.
Die Kurvenanpassung wurde für Infrarotspektren durchgeführt, die bei 40 und 100 °C erhalten wurden. Tabelle 2 listet die Bedingungen für die Kurvenanpassung auf. Das Infrarotspektrum vor der Kurvenanpassung, die einzelnen durch die Kurvenanpassung bestimmten Peaks und das daraus synthetisierte Spektrum sind in Abb. 3 und 4 dargestellt. Die Überprüfung, wie eng das aus den getrennten Peaks synthetisierte Spektrum mit dem Spektrum vor der Kurvenanpassung übereinstimmt, bietet eine wirksame Methode zur Bestätigung, dass die Kurvenanpassung ordnungsgemäß durchgeführt wurde. In diesem Fall stimmen die schwarzen und roten Linien (ursprüngliche und synthetisierte Spektren) in Abb. 3 und 4 sehr genau überein. Daher kamen wir zu dem Schluss, dass die Ergebnisse der Kurvenanpassung gut waren.
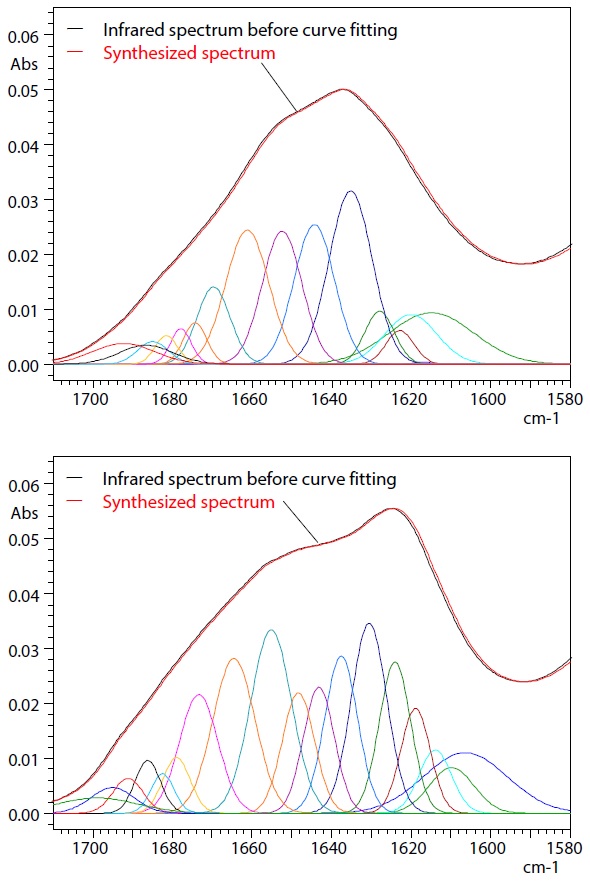
Tabelle 2 Bedingungen für die Kurvenanpassung
| Art der Peak-Kurve | Gaußsche Funktion |
| Baselinie | Versatz 1 Pt |
| Bereich | 1.710 bis 1.580 cm-1 |
| Max. Fehler | 0,01 % |
Analyse einzelner durch Kurvenanpassung ermittelter Peaks
Die Peakerkennungsfunktion wurde zur Bestimmung der Wellenzahl und der Flächenwerte für jeden Peak verwendet, die durch Kurvenanpassung ermittelt wurden. Nach der Zuweisung von Sekundärstrukturen zu jeder Wellenform gemäß der Referenz*** wurde das Verhältnis von ihnen berechnet. Die Ergebnisse sind in Tabelle 3 dargestellt.
Ein Vergleich der Ergebnisse für 40 und 100 °C zeigt, dass das Verhältnis von β-Blättern und β-Windungen mit steigender Temperatur zunimmt. Eine Überprüfung jedes Peaks, der von einem β-Blatt stammt, zeigt, dass das Verhältnis der β-Blätter in der Nähe von 1693 cm-1 und 1622 cm-1 zunahm, während das in der Nähe von 1637 cm-1 abnahm. Diese Ergebnisse stimmen mit den in Abb. 2 dargestellten spektralen Trends der zweiten Ableitung überein. Die Abnahme der α-Helix-Strukturen stimmt auch mit dem Trend im Spektrum der zweiten Ableitung überein.
Tabelle 3 Temperaturbedingte Veränderung der Sekundärstrukturen von Proteinen
| α-Helices | β-Blätter | β-Rückkehr | Zufällige Spulen | |
|---|---|---|---|---|
| 40°C | 30,3 % | 37,9 % | 16,4 % | 15,4 % |
| 100°C | 15,1 % | 47,6 % | 29,7 % | 7,7 % |
Fazit
Die Sekundärstrukturen von Protein in Hühnereiweiß wurden durch Kurvenanpassung in der Amid-I-Bande analysiert. Wenn Eiklar von 40 auf 100 °C erhitzt wurde, begannen die Proteine bei 60 °C zu denaturieren, was das Verhältnis von α- Helices verringerte und das Verhältnis von β-Sheets erhöhte. Es wurde berichtet, dass die thermische Denaturierung sekundäre Strukturen und Strukturen höherer Ordnung aufbricht und einen Teil der α- Helix-Strukturen**** entfaltet, was mit den hier gezeigten Ergebnissen der Kurvenanpassung übereinstimmt. Die Verwendung der FTIR-Analyse machte es einfach, die durch thermische Denaturierung von Proteinen verursachten Veränderungen der Sekundärstrukturen zu messen und zu überprüfen.
Referenzen:
*JENNIFER KOVACS-NOLAN. Advances in the Value of Eggs and Egg Components for Human Health. J. Agric. Food Chem. 2005, 53, 8421-8431
**Yoshinori Mine, Tatsushi Noutomi, and Noriyuki Haga Thermally induced changes in egg white proteins. J. Agric. Food Chem., 1990, 38 (12), pp 2122–2125
***Jilie KONG, Shaoning YU. Fourier Transform Infrared Spectroscopic Analysis of Protein Secondary Structures. Acta Biochim Biophys Sin 2007, 39(8): 549–559
****A. Kato and T.Takagi, Formation of intermolecular .beta.-sheet structure during heat denaturation of ovalbumin. J. Agric. Food Chem. 1988, 36, 1156-1159