Methode zur Analyse mehrerer COVID-19-Medikamente durch LC-MS/MS
Einführung
Die COVID-19-Pandemie beschleunigte den Einsatz von Medikamenten zur Behandlung von Patienten weltweit. Der Mangel an Wissen über Konzentration und Pharmakokinetik ist ein Problem, um die richtige Dosis vorzuschlagen. Die Shimadzu-Tochter ALSACHIM hat eine LC-MS/MS-Methode zur Überwachung dieser Medikamente (Favipiravir, GS 441524, Remidesivir, Hydroxychloroquin, Desethychloroquin, Chloroquin) entwickelt und stellt sie hier vor, Azithomcyin, Ritonavir, Lopinavir), die in mehr als 50% der weltweit bei COVID-19-Patienten durchgeführten klinischen Tiralen eingesetzt wurden.
Methoden
| HPLC-Bedingungen | MS-Bedingungen | ||
|---|---|---|---|
| Analytische Säule | C18 2.1x50mm, 5µm | Ionisierung | ESI Positiv |
| Mobile Phase A | H20 + 0,1% Ameisensäure | DL-Temperatur | 200°C |
| Mobile Phase B | MeOH + 0,1% Ameisensäure | Wärmeblock-Temp. | 300°C |
| Flussrate | 0,5 mL/min | Interface-Temp. | 250°C |
| Ofentemperatur | 30°C | Zerstäubergasfluss | 2 L/min |
| Trocknungsgasfluss | 10 L/min | ||
| Heizgasfluss | 10 L/min |
Probenvorbereitung
Diese Methode umfasst 9 Analyten (Favipiravir, GS 441524, Remdesivir, Hydroxychloroquin, Desethylchloroquin, Chloroquin, Azithromcyin, Ritonavir, Lopinavir) und ihre entsprechenden stabilen isotopmarkierten Standards.
Die Proben werden wie folgt vorbereitet:
1) 50 µL Plasmaprobe in 1,5 mL Mikroröhrchen geben
2) 200 µL MeOH mit internem Standard hinzufügen
3) Vortex 1 min
4) Zentrifuge 7 min bei 15.000 g
5) Den Überstand mit mobiler Phase A verdünnen: 100 µL der mobilen Phase A in ein Fläschchen mit Einsatz geben und 50 µL des Überstands hinzufügen (Verdünnungsfaktor vor der Analyse kann erhöht werden).
Injektionsvolumen: 1 µL (abhängig von der Empfindlichkeit des Massenspektrometers)
Die behandelten Proben wurden durch eine analytische Säule bei 30°C innerhalb von 6 Minuten getrennt. Das Gradientenprogramm wird in Tabelle 1 beschrieben. Als Geräte wurden die Shimadzu Nexera X2 und das LCMS-8050 mit Elektrospray-Ionisierung im positiven Ionenmodus genutzt. Parameter für die Überwachung von Mehrfachreaktionen (MRM) sind in Tabelle 2 dargestellt.
| Zeit (Min) | Ereignis | % |
|---|---|---|
| 0.00 | Pumpe B Konz. | 1 |
| 3.00 | Pumpe B Konz. | 99 |
| 4.00 | Pumpe B Konz. | 99 |
| 4.50 | Pumpe B Konz. | 1 |
| 6.00 | Stop | - |
Tabelle 1: Gradientenprogramm
| Moleküle | Ref. | Übergänge MRM (1) | Übergänge MRM (2) |
|---|---|---|---|
| Favipiravir | C8720 | 158,20>113,10 | 158,20>85,10 |
| GS 441524 | C8847 | 292,00>163,10 | 292,00>147,10 |
| Remdesivir | C8799 | 603,20>200,10 | 603,20>402,20 |
| Hydroxylchloroquin | C4600 | 336,10>247,15 | 336,10>179,10 |
| Desthylchloroquin | C2331 | 292,10>179,05 | 292,10>114,20 |
| Chloroquin | C1741 | 320,10>247,15 | 320,10>142,20 |
| Azithromycin | C1746 | 749,40>591,50 | 749,40>158,20 |
| Ritonavir | C2792 | 721,20>296,25 | 721,20>228,25 |
| Lopinavir | C2745 | 629,30>155,15 | 629,30>447,30 |
| [13C, 15N]-Favipiravir | C8853 | 160,00>113,10 | 160,00>85,10 |
| [13C5]-GS 441524 | C8855 | 297,20>164,10 | 297,20>148,10 |
| [U-Ring-13C6]-Remdesivir | C8854 | 609,20>206,20 | 609,20>408,35 |
| [2H5]-Hydroxylchloroquin | C6422 | 341,30>247,20 | 341,30>179,20 |
| [2H5]-Desthylchloroquin | C2453 | 297,10>179,20 | 297,10>119,20 |
| [2H5]-Chloroquin | C5023 | 325,15>247,20 | 325,15>147,25 |
| [13C, 2H3]-Azithromycin | C1768 | 753,50>595,50 | 753,50>158,25 |
| [13C, 2H3]-Ritonavir | C2963 | 725,35>300,20 | 725,35>272,20 |
| [2H8]-Lopinavir | C4693 | 637,35>163,30 | 637,35>447,35 |
Ergebnisse
Wir führten gleichzeitige Analysen über einen Konzentrationsbereich von bis zu 2.000 ng/mL für 7 Moleküle und bis zu 10.000 ng/mL für Ritonavir und Lopinavir durch. Die erstellten Kalibrierkurven wiesen für jede Kurve lineare Regressionswerte von r2>0,99 auf. Die CV%-Werte der Konzentration lagen innerhalb akzeptabler analytischer Bereiche (<15%).
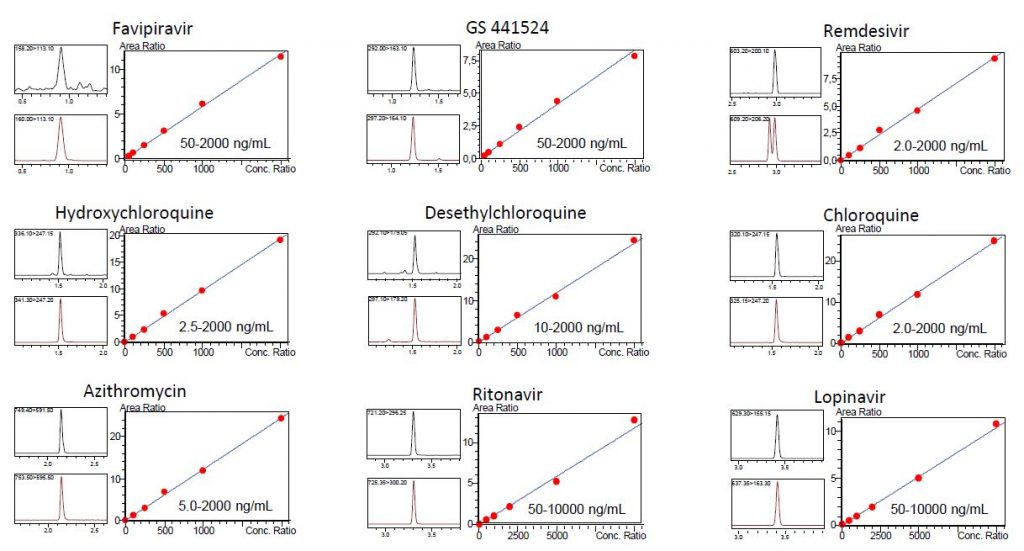
Schwarzer Peak: unmarkierte Verbindung
Roter Peak: markierte Verbindung (für Remdesivir ist die markierte Verbindung eine Mischung von Diastereoisomeren)
| Favipiravir | GS 441524 | Remdesivir | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Konzentration (ng/mL) | 50 | 100 | 1.000 | 50 | 100 | 1.000 | 25 | 100 | 1.000 |
| Durchschnitt (ng/mL) | 49,8 | 99,8 | 1.092,5 | 47,6 | 99,6 | 1.035,2 | 23,1 | 97,8 | 988,9 |
| CV (%) | 4,4 | 8,6 | 5,9 | 10,6 | 6,9 | 4,6 | 4,1 | 3,7 | 1,9 |
| Abweichung | -0,5 | -0,2 | 9,3 | -4,9 | -0,4 | 3,5 | -7,5 | -2,2 | -1,1 |
| Hydroxylchloroquin | Desethylcloroquin | Chloroquin | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Konzentration (ng/mL) | 25 | 100 | 1.000 | 50 | 100 | 1.000 | 25 | 100 | 1.000 |
| Durchschnitt (ng/mL) | 24,4 | 96,6 | 1.003,0 | 47,6 | 95,2 | 949,2 | 24,2 | 95,6 | 963,2 |
| CV (%) | 3,6 | 3,0 | 2,4 | 4,4 | 2,2 | 5,6 | 3,3 | 3,0 | 1,8 |
| Abweichung | -2,5 | -3,4 | 0,3 | -4,7 | -4,8 | -5,1 | -3,2 | -4,4 | -3,7 |
| Azithromycin | Ritonavir | Lopinavir | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Konzentration (ng/mL) | 25 | 100 | 1.000 | 100 | 500 | 1.000 | 100 | 500 | 1.000 |
| Durchschnitt (ng/mL) | 24,9 | 97,2 | 962,2 | 98,3 | 498,6 | 891,3 | 92,1 | 503,7 | 917,2 |
| CV (%) | 6,6 | 2,5 | 2,0 | 3,2 | 2,0 | 3,1 | 2,0 | 0,8 | 1,3 |
| Abweichung | -0,6 | -2,8 | -3,8 | -1,7 | -0,3 | -10,9 | -7,9 | 0,7 | -8,3 |
Abbildung 1: Kalibrierkurven, MRM-Chromatogramme (bei Kalibratorstufe 1) und Zusammenfassung der Wiederholbarkeit