Qualitätskontrolle synthetischer Peptide
Innerhalb des Herstellungsprozesses von Bio-Therapeutika spielt die Qualitätskontrolle (QC) eine grundlegende Rolle, um die Lieferung eines qualitativ hochwertigen Produkts zu gewährleisten. Jede Veränderung oder Modifikation in der Peptidsequenz des Endproduktes kann die therapeutischen Eigenschaften beeinflussen und zu einem potenziellen Aktivitätsverlust oder zur Entwicklung von Toxizität führen. Unter einer Vielzahl an verschiedener analytischen Techniken zur Qualitätskontrolle von synthetischen Biomolekülen ist die Verwendung von MALDI-TOF Massenspektrometrie weit verbreitet. Der Vorteil hier liegt in der schnellen und einfachen Bedienung, niedrigen Betriebskosten, der Empfindlichkeit und der Fähigkeit, Informationen über das Molekulargewicht sowie die Sequenz und Struktur einer Verbindung, ihrer Verunreinigungen/Additive und Modifikationsprodukte zu erhalten.
Ein bekanntes Beispiel einer Modifikation während des Abbaus von Biomolekülen beschreibt die Oxidation der Aminosäure Methionin bei Peptiden oder Proteinen.
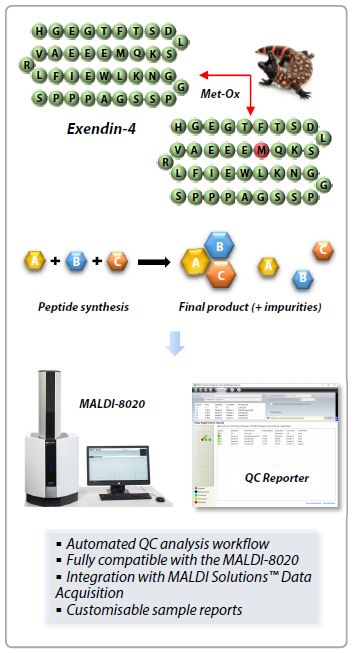
Hier bieten wir eine komplette Workflow-Lösung für die automatisierte Qualitätskontrollanalyse von synthetischen Produkten mit hohem Durchsatz unter Verwendung des linearen Shimadzu MALDI-8020 Benchtop-MALDI-TOF-Massenspektrometers und der QC Reporter-Software (Abb. 1).
Proben und Methode
Vier Proben von synthetischen Peptiden mit unterschiedlichen Mengen an Verunreinigungen wurden freundlicherweise von Bachem (Vereinigtes Königreich) zur Verfügung gestellt. Das Peptid Exendin-4 wurde von Sigma-Aldrich bezogen. Die Oxidation von Methionin wurde mit 1 % Wasserstoffperoxid bei 37 ºC (15 min) erzeugt. Nach der Oxidation wurde die Probe mit einer ZipTip C18-Mikrosäule (Millipore) gereinigt. Für die MALDI-Analyse wurden alle Proben mit alpha-Cyano-4-Hydroxyzimtsäure (CHCA, 5 mg/mL, 1:1 Acetonitril/0,1 % Trifluoressigsäure) auf das Probentarget appliziert.
Ergebnisse
Exendin-4 ist ein natürlich vorkommendes Peptid, das im Speichel der Gila-Krustenechse vorkommt (Heloderma suspectum, Abb. 1). Die synthetische Form, Exenatide, wird bei der Behandlung von Diabetes mellitus Typ 2 eingesetzt.
Die Analyse von Exendin-4 und seiner modifizierten Form wurde mit der Software QC Reporter durchgeführt, um einen typischen Ablauf einer Routine-Qualitätskontrolle darzustellen. Um den Abbau von Exendin-4 zu simulieren, wurde das Peptid einer chemischen Oxidation unterzogen, bei der der einzelne Methioninrest zu seiner Sulfoxidform modifiziert wird und eine Massenverschiebung der einheimischen Spezies von den typischen +16 Da beobachtet wird. Um einen partiellen Abbau zu simulieren, wurde eine Mischung aus nativem und met-Ox Exendin-4 hergestellt.
Abb. 2 veranschaulicht das Ergebnisfenster der Software QC Reporter, das die Ergebnisse des QC-Experiments farbcodiert darstellt. Als „Ziel“-Masse zu Kontrolle wurde 4186,6 Da gewählt, was der neutralen Durchschnittsmasse von nativem Exendin-4 entspricht. Dies wird von der QC Reporter-Software verwendet, um die protonierte ([M+H]+)-Form der Zielspezies zu berechnen, die dann im erfassten Massenspektrum gesucht wird. Der Einsatz unten rechts in Abb. 2 zeigt die Einstellungen der Qualitätskriterien, die zur Berechnung und Generierung der Probenergebnisse verwendet werden. Diese beziehen sich auf: Massentoleranz für die Zielmasse, maximal zulässige Addukte und Verunreinigungswerte (auf 50 % der Fläche der Zielmasse festgelegt).
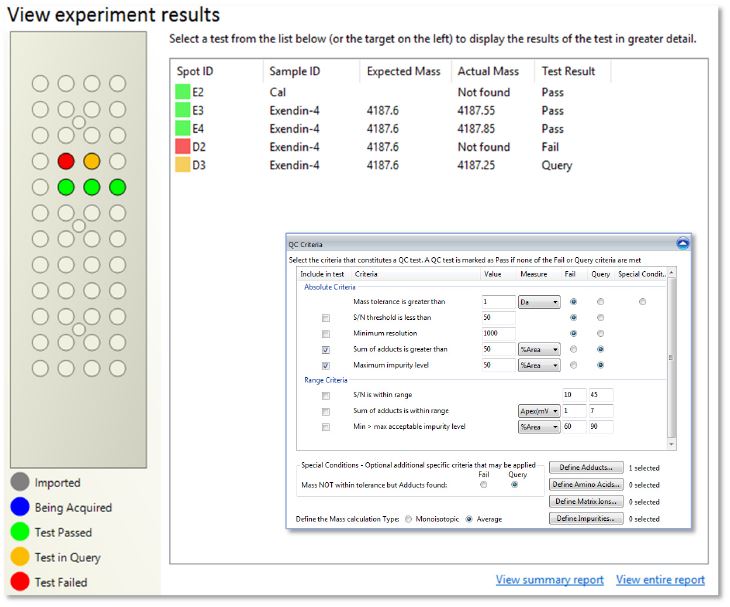
Abb. 2 Hauptfenster der Software QC-Reporter, das die farbkodierten Ergebnisse in Bezug auf das QC-Experiment von Exendin-4 zeigt. Der Einsatz unten rechts zeigt die Qualitätskriterien, die zur Berechnung der Ergebnisse verwendet wurden.
In Abb. 3a wurde die erwartete Zielmasse (m/z 4187,6, [M+H]+) erfolgreich nachgewiesen und die Probe als „Pass“ ausgegeben. Der Einschub in Abb. 3a zeigt den Teil des generierten Berichts mit den Details des Probenergebnisses. In Abb. 3b wurde der Peak bei der erwarteten Masse von Exendin-4 nicht gefunden, stattdessen wurde die oxidierte Spezies des Peptids (+16 Da; m/z 4203.6, [M+H]+) detektiert und in den Bericht aufgenommen (Abb. 3c). Infolgedessen wurde die Probe als „Fail“ gemeldet. Das in Abb. 3b gezeigte Beispiel könnte ein Szenario darstellen, bei dem eine vollständige Degradation durch Oxidation stattgefunden hat.
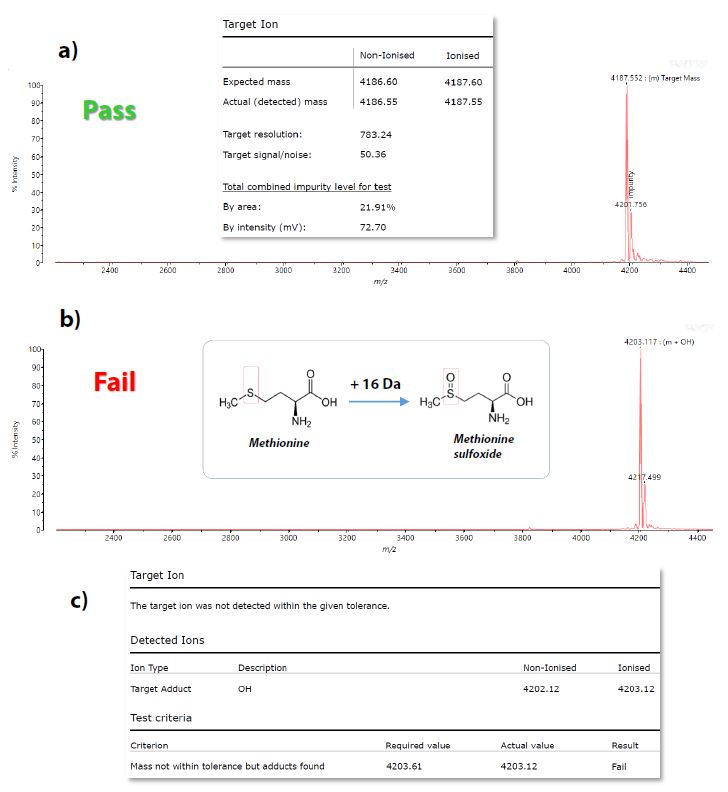
Abb. 3 a) MALDI-Spektrum aus dem QC-Experiment mit erfolgreicher Detektion der Zielmasse m/z (4187.6, [M+H]+), das in einem ‚Pass‘-Ergebnis resultierte; Einfügung: Details der Probenergebnisse aus dem generierten Bericht.
b) MALDI-Spektrum aus dem QC-Experiment, das aufgrund des Fehlens des erwarteten m/z-Targets zu einem „Fail“-Ergebnis führte; Einfügung: Mechanismus der Oxidation eines Methionin-Rückstands.
c) Einzelheiten der Probenergebnisse aus dem generierten Bericht, in denen hervorgehoben wird, dass das Ziel-Addukt (m/z 4203.61, [M+H]+) nachgewiesen wurde. Zur Berechnung der protonierten ([M+H]+) oxidierten Peptidspezies wurde OH als Addukt angegeben, wobei „O“ der Addition des Sauerstoffelements entspricht und „H“ für das ionsierende Proton steht.
In Abb. 4a wurde das Ergebnis des QC-Experiments für die native und met-Ox Exendin-4-Mischung als „Query“ dargestellt. Dies deutet darauf hin, dass, obwohl die Zielmasse der einheimischen Spezies (m/z 4187,6, [M+H]+) festgestellt wurde, der prominente Peak der met-Ox-Spezies (m/z 4203,61, [M+H]+) über 50 % der Fläche der Zielmasse lag, wie in den QC-Kriterien angegeben und im Probenbericht berichtet (Abb. 2 bzw. Abb. 4b).
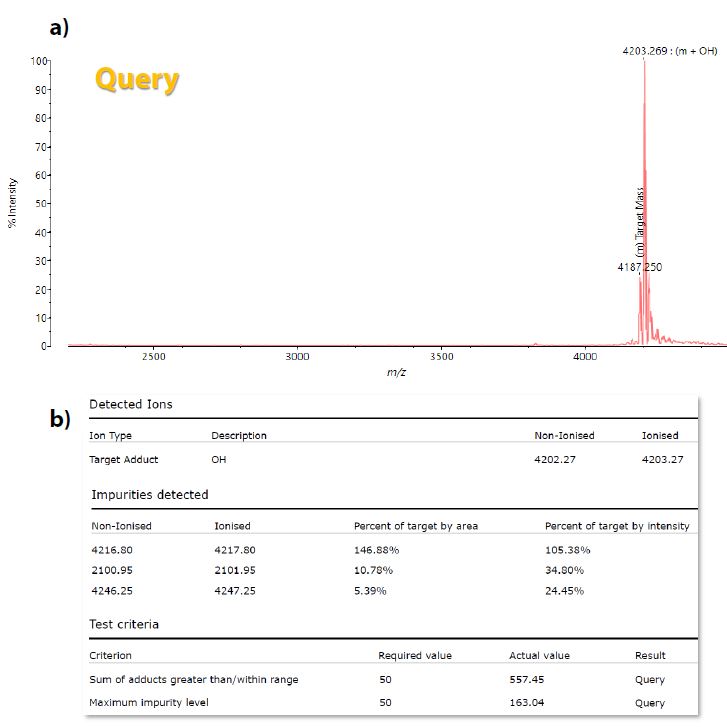
Abb. 4 a) MALDI-Spektrum aus dem QC-Experiment, das aufgrund des Vorliegens eines auffälligen Spitzenwertes der oxidierten Form als Begleiterscheinung der einheimischen Spezies in einem ‚Query‘-Ergebnis resultierte. b) Details der Probenergebnisse aus dem generierten Bericht, die hervorheben, dass die Zielmenge des Addukts die spezifizierten 50 % der Fläche der Zielmasse überschritt
Die Abb. 5a-c zeigen die Ergebnisse des QC-Experiments für drei Peptidsyntheseprodukte. Wie man beobachten kann, wurden alle erwarteten Zielmassen (m/z 1287.73, 1503.82 und 1740.94, [M+H]+) erfolgreich nachgewiesen. Die Einsätze oben links in den Massenspektren aus den generierten Probenberichten zeigen, dass alle drei Peptide die angegebenen QC-Kriterien erfüllten: minimaler Signaltonus der Zielmasse (eingestellt als 10), maximale Menge an Addukten (Natrium und Kalium) und an Verunreinigungen, beide eingestellt auf ≤ 50 % der Fläche der Zielmasse.
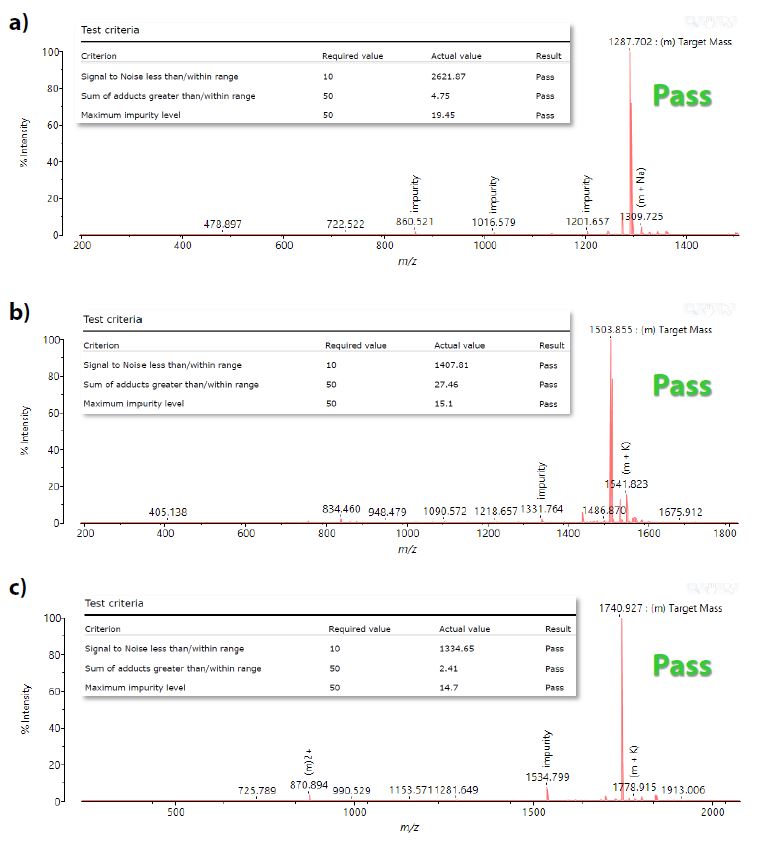
Abb. 5a-c MALDI-Spektren aus dem QC-Experiment mit erfolgreicher Detektion der Zielmassen (m/z 1287.73, 1503.82 und 1740.94, [M+H]+), die in ‚Pass‘-Ergebnissen resultierten.
Oben links Einsätze: Einzelheiten zu den Stichprobenergebnissen aus den generierten Berichten, aus denen hervorgeht, dass alle angegebenen QC-Kriterien erfolgreich erreicht wurden.
Die Abb. 6a-c zeigen die Ergebnisse des QC-Experiments für eines der synthetischen Peptide, das erhebliche Mengen an Verunreinigungen enthält, die aus verkürzten Zwischenprodukten der Synthese bestehen, die eine Acetylgruppe tragen (in Abb. 6a geschätzte MWs). Wie in Abb. 6b zu sehen ist, wurde die Zielmasse (m/z 1560,89, [M+H]+) zusammen mit Peaks, die mit den berechneten Prozessverunreinigungen übereinstimmen, erfolgreich nachgewiesen. Abb. 6c veranschaulicht den Teil des erzeugten Probenberichts, in dem gezeigt wird, dass das Experiment aufgrund des nicht erreichten Verunreinigungskriteriums zu einem „Fail“ führte.
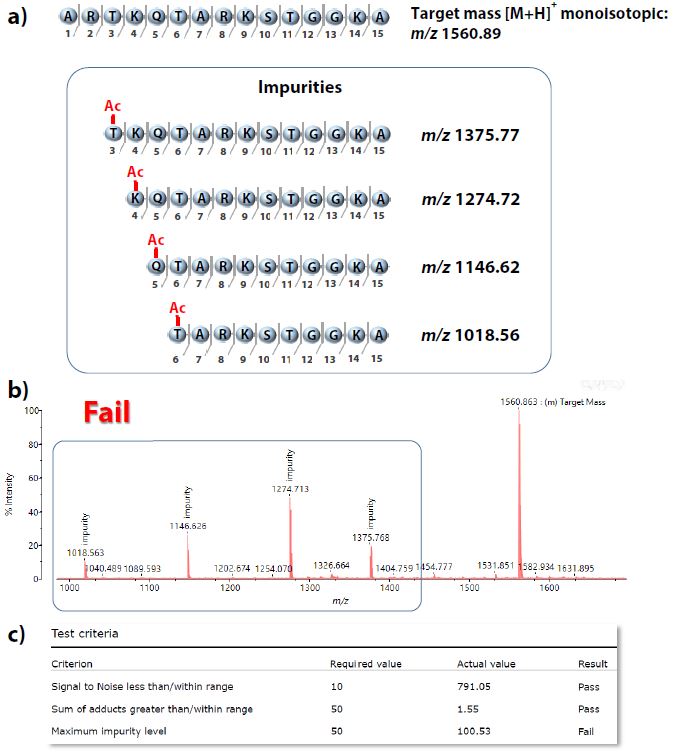
Abb. 6 a) Sequenzen und berechnete Molekulargewichte des Peptidendproduktes und seiner Verunreinigungen (verkürzte acetylierte Zwischenprodukte).
b) MALDI-Spektrum aus dem QC-Experiment des synthetischen Peptids, erwartet bei m/z 1560,89 ([M+H]+), das aufgrund des Vorhandenseins von auffälligen Verunreinigungs-Peaks, die mehr als 50 % der Fläche der Zielmasse ausmachen und zu einem „Fail“-Ergebnis führen.
c) Einzelheiten zu den Probenergebnissen aus dem generierten Bericht, aus denen hervorgeht, dass die Menge der Verunreinigungen die angegebenen 50 % der Fläche der Zielmasse überschritten hat.