Pufferlösungen für die Flüssigchromatographie
pKs-Wert und Dissoziationsgleichgewicht
1. pH-Wert
Wenn Salzsäure oder eine andere Säure zu Wasser hinzugefügt wird, sinkt der pH-Wert. Der Säuregrad einer Lösung wird durch ihre Protonenkonzentration (Wasserstoffionen) ([H+]) bestimmt, wobei der pH-Wert einen einfachen Index für den [H+]-Gehalt darstellt. Der pH-Wert wird anhand des folgenden Ausdrucks angegeben, wobei der Säuregrad umso stärker ist, je kleiner die Zahl ist (höhere Protonenkonzentration).
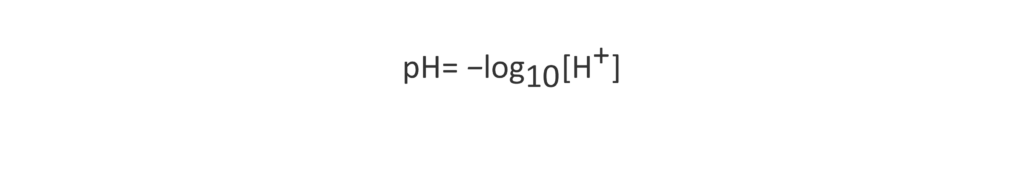
Dabei ist zu berücksichtigen, dass eine Änderung des pH-Wertes um nur 1 einer 10-fachen Änderung der Protonenkonzentration entspricht.
Anmerkung: Anstelle der Konzentration sollte das Aktivitätsniveau verwendet werden, aber die Konzentration wurde anstelle der Aktivität verwendet, weil die Konzentration häufig dem Aktivitätsniveau in analytischen Konzentrationen entspricht und einfacher ist (dasselbe gilt auch für die folgenden Punkte).
2. pKs-Wert und Dissoziationsgleichgeweicht
Zu den Säuren gehören starke Säuren, die in Wasser vollständig dissoziieren, und schwache Säuren, die nur teilweise dissoziieren. Wenn eine Säure dissoziiert, gibt sie ein Proton ab und macht die Lösung sauer. Schwache Säuren haben jedoch sowohl einen dissoziierten Zustand (A–) als auch einen undissoziierten Zustand (AH), die gemäß der folgenden Dissoziationsgleichung nebeneinander bestehen.
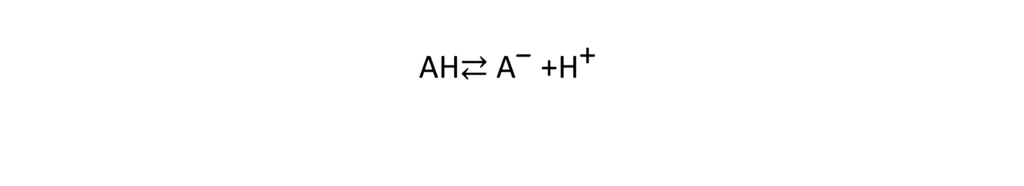
Das Konzentrationsverhältnis der beiden Seiten ist bei festen Analysebedingungen konstant und wird als Säuredissoziationskonstante (KS) bezeichnet. KS ist durch die folgende Gleichung definiert.
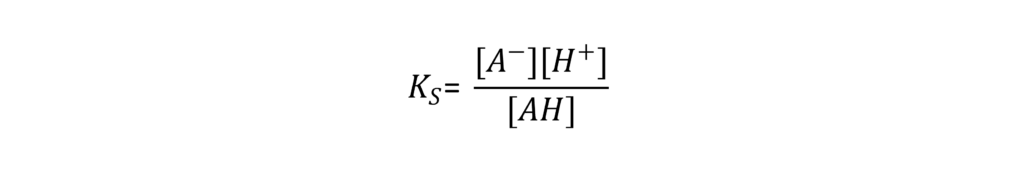
Die eckigen Klammern geben die Konzentration der jeweiligen Komponenten an. Auf Grundlage dieser Gleichung drückt KS aus, wie leicht die Säure ein Proton abgibt (mit anderen Worten, ihre Stärke als Säure). Außerdem zeigt die Gleichung, wie sich der Dissoziationszustand schwacher Säuren in Abhängigkeit vom [H+]-Gehalt in der Lösung verändert.
Carbonsäuren (mit -COOH), wie Essig- und Milchsäure, haben normalerweise eine KS-Konstante von etwa 10-3 bis 10-6. Folglich ist die Angabe des Säuregehalts durch die KS-Konstante allein unpraktisch und nicht sehr intuitiv.
Daher wurde pKS als Index eingeführt, um den Säuregrad von schwachen Säuren auszudrücken, wobei pKS wie folgt definiert ist.
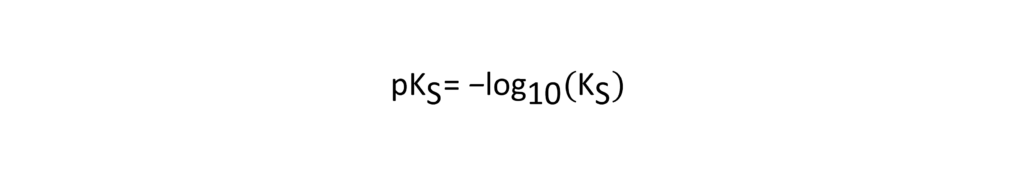
Die Ka-Konstante für Essigsäure (CH3COOH) beträgt zum Beispiel 0,0000158 (= 10-4,8), die pKS-Konstante ist jedoch 4,8, was einen einfacheren Ausdruck darstellt. Außerdem gilt: Je kleiner der pKS-Wert, desto stärker ist die Säure. Der pKS-Wert von Milchsäure liegt beispielsweise bei 3,8, d. h. Milchsäure ist eine stärkere Säure als Essigsäure.
3. pKs und Pufferkapazität
Ein weiterer wichtiger Punkt ist die Beziehung zwischen dem pH-Wert und dem pKS-Wert einer Säure. Diese Beziehung wird durch die folgende Gleichung beschrieben.
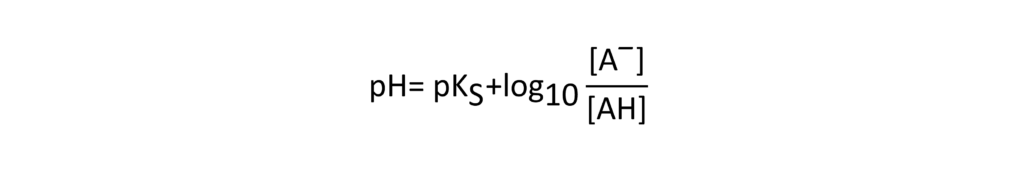
Diese Gleichung kann wie folgt umgestellt werden.
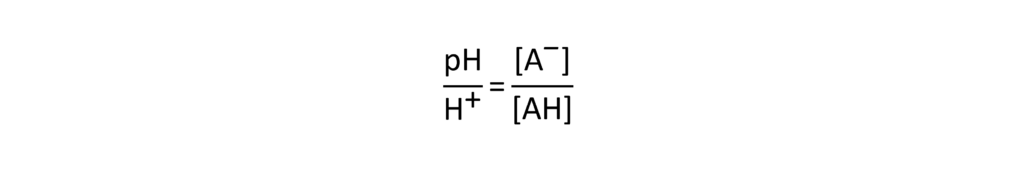
Dies zeigt, dass pKS und pH gleich sind, wenn genau die Hälfte der Säure dissoziiert ist ([A– ]/[AH] = 1). Wenn sich der pH-Wert in der Nähe des pKS-Wertes um 1 ändert, ändert sich der Dissoziationsstatus der Säure um einen großen Betrag.
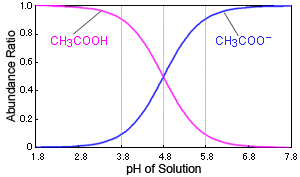
Ändert sich beispielsweise der pH-Wert der Lösung in der Nähe von 4,8, so führt dies zu einer starken Veränderung der Essigsäurekonzentration. Bei einem pH-Wert von 3,8 liegen über 90 % als Essigsäuremoleküle (CH3COOH) vor, bei einem pH-Wert von 5,8 jedoch über 90 % als Acetat-Ionen (CH3COO–).
Um den pH-Wert in der Nähe des pKS-Wertes einer Säure zu ändern, muss der Dissoziationsstatus der Säure erheblich verändert werden, was die Verwendung einer extrem großen Menge an Säure oder Base erfordert. Die Fähigkeit einer Substanz, den pH-Wert einer solchen Lösung aufrechtzuerhalten, wird als Pufferkapazität bezeichnet, wobei die Pufferkapazität umso höher ist, je näher pKS und pH-Wert beieinander liegen. Daher wird bei der Auswahl einer Pufferlösung, die in der Flüssigchromatographie weit verbreitet ist, eine Säure- oder Basenpufferlösung mit einem pKS-Wert in der Nähe des Ziel-pH-Wertes gewählt, um diese Pufferkapazität zu maximieren.
Vorbereitung von Pufferlösungen
Um die Trennung der Komponenten zu verbessern und die Lebensdauer der Säule bei der Chromatographie zu verlängern, muss ein bestimmter pH-Wert der mobilen Phase (Eluent) eingestellt werden. Bei dieser pH-Einstellung sollte nicht einfach nur eine Säure oder Lauge in das Fließmittel getropft werden, sondern nach Möglichkeit mit entsprechenden Pufferlösungen für den gewünschten pH-Bereich gearbeitet werden. Es wird eine gute Reproduzierbarkeit der Trennung (Stabilität) ermöglicht, da die Pufferlösungen den pH-Wert in der Lösung stabilisieren.
Was sind Pufferlösungen?
Eine Pufferlösung wird als Kombination aus einer schwachen Säure und ihrer konjugierten Base (bzw. des entsprechenden Salzes) oder aus einer schwachen Base und ihrer konjugierten Säuren (bzw. des entsprechenden Salzes) hergestellt. Zu den üblichen Zubereitungsmethoden gehören: 1) Eintropfen einer Säure (oder Lauge) in eine wässrige Lösung des jeweils konjugierten Salzes unter Messung des pH-Werts mit einem pH-Meter und 2) Herstellung einer wässrigen Lösung einer Säure mit derselben Konzentration wie das Salz und Mischen unter Messung des pH-Werts mit einem pH-Meter. Wenn die Pufferlösung jedoch als mobile HPLC-Phase verwendet wird, können selbst kleine Fehler im pH-Wert zu Problemen bei der Reproduzierbarkeit der Trennung führen. Daher ist es wichtig, jedes verwendete pH-Meter sorgfältig zu überprüfen und zu kalibrieren. Auf dieser Seite wird eine Methode vorgestellt, die nicht auf einem pH-Meter beruht. Bei dieser Methode werden theoretisch berechnete feste Mengen eines Salzes und einer Säure (oder Lauge) gewogen, wie in der folgenden Tabelle dargestellt. Beachten Sie dabei die folgenden wichtigen Punkte.
Bezeichnung von Pufferlösungen
Eine Pufferlösung mit der Bezeichnung „100 mM Phosphorsäure (Natrium) Pufferlösung pH = 2,1“ enthält beispielsweise Phosphorsäure als Säure, Natrium als Gegenion, 100 mM Gesamtkonzentration der Phosphorsäuregruppe und einen garantierten pH-Wert der Pufferlösung von 2,1.
Maximale Pufferwirkung in der Nähe des Säure- (oder Alkali-) pKs-Wertes
Wenn eine Essigsäure-(Natrium-)Pufferlösung z. B. aus Essigsäure und Natriumacetat im Verhältnis 1:1 hergestellt wird, liegt der pH-Wert der Pufferlösung bei etwa 4,7 (nahe dem Essigsäure-pKS), und bei diesem Wert kann die maximale Pufferwirkung erzielt werden.
Die Pufferkapazität steigt mit zunehmender Konzentration
Die Pufferkapazität einer Essigsäure-(Natrium-)Pufferlösung ist bei einer Konzentration von 100 mM größer als z. B. bei 10 mM. Allerdings kommt es bei höheren Konzentrationen leichter zu Ausfällungen.
Vorsicht bei Salzlöslichkeit und Ausfällung
Die Löslichkeit von Salzen hängt von der Art des Salzes ab, z. B. Kaliumsalz oder Natriumsalz. Salze fallen leichter aus, wenn ein organisches Lösungsmittel beigemischt wird.
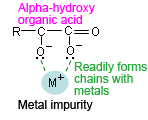
Vermeiden Sie außerdem bei hochempfindlichen Analysen so weit wie möglich die Verwendung von Pufferlösungen auf der Basis organischer Säuren (Carbonsäuren) die bei kurzen UV-Wellenlängen absorbieren können. Berücksichtigen Sie die verschiedenen Analysebedingungen und verwenden Sie eine geeignete Pufferlösung, z.B. eine organische Säure mit einer Hydroxylgruppe an der α-Position (siehe Anhang), um die Auswirkungen von Verunreinigungen von Metallionen zu begrenzen. Eine organische Säure mit einer Hydroxylgruppe (Zitronensäure, Weinsäure usw.) an der α-Position hat eine „Krebsscheren“-Struktur, die leicht Metallverunreinigungen in der mobilen Phase komplexieren kann.
Methoden zur Herstellung von Pufferlösungen
Zur Herstellung der gängigsten Pufferlösungen sind im Folgenden einige Vorschläge aufgeführt. Die pH-Werte sind grundsätzlich bei den angegebenen Zusammensetzungen gut eingestellt, aber es wird empfohlen den genauen pH-Wert mit kalibrierten pH-Messinstrumenten zu überprüfen und ggf. mit der entsprechenden zum Puffer passenden Säure (z.B. Phosphorsäure) oder Base (z.B. NaOH) nachträglich auf den gewünschten pH-Wert einzustellen.
100 mM Phosphorsäure (Natrium) Pufferlösung (pH=2,1)
- 50 mmol (≙ 7,8 g) Natriumdihydrogenphosphat-Dihydrat (M=156,01 g/mol)
- 50 mmol (≙ 3,4 mL) Phosphorsäure (85 %, 14,7 mol/L)
- Mit Wasser auf 1 l auffüllen.
10 mM Phosphorsäure (Natrium) Pufferlösung (pH=2,6)
- 5 mmol (≙ 0,78 g) Natriumdihydrogenphosphat-Dihydrat (M=156,01 g/mol)
- 5 mmol (≙ 0,34 mL) Phosphorsäure (85 %, 14,7 mol/L)
- Mit Wasser auf 1 l auffüllen.
(Alternativ kann man auch 100 mM Phosphorsäure (Natrium) Pufferlösung (pH=2,1) ansetzen und 10-fach verdünnen).
50 mM Phosphorsäure (Natrium) Pufferlösung (pH=2,8)
- 40 mmol (≙ 6,24 g) Natriumdihydrogenphosphat-Dihydrat (M=156,01 g/mol)
- 10 mmol (≙ 0,68 mL) Phosphorsäure (85 %, 14,7 mol/L)
- Mit Wasser auf 1 l auffüllen.
100 mM Phosphorsäure (Natrium) Pufferlösung (pH=6,8)
- 50 mmol (≙ 7,8 g) Natriumdihydrogenphosphat-Dihydrat (M=156,01 g/mol)
- 50 mmol (≙ 17,9g) Natriumdihydrogenphosphat 12-Hydrat (M=358,14 g/mol)
- Mit Wasser auf 1 l auffüllen.
10 mM Phosphorsäure (Natrium) Pufferlösung (pH=6,9)
- 5 mmol (≙ 0,78 g) Natriumdihydrogenphosphat-Dihydrat (M=156,01 g/mol)
- 5 mmol (≙ 1,79 g) Natriumdihydrogenphosphat 12-Hydrat (M=358,14 g/mol)
- Mit Wasser auf 1 l auffüllen.
(Alternativ kann man auch 100 mM Phosphorsäure (Natrium) Pufferlösung (pH=6,8) ansetzen und 10-fach verdünnen).
20 mM Citronensäure (Natrium) Pufferlösung (pH=3,1)
- 16,7 mmol (≙ 3,51 g) Citronensäure-Monohydrat (M=210,14 g/mol)
- 3,3 mmol (≙ 0,97 g) Trinatriumcitrat-Dihydrat (M=294,10 g/mol)
- Mit Wasser auf 1 l auffüllen.
20 mM Citronensäure (Natrium) Pufferlösung (pH=4,6)
- 10 mmol (≙ 2,1 g) Citronensäure-Monohydrat (M=210,14 g/mol)
- 10 mmol (≙ 2,94 g) Trinatriumcitrat-Dihydrat (M=294,10 g/mol)
- Mit Wasser auf 1 l auffüllen.
10 mM Weinsäure (Natrium) Pufferlösung (pH=2,9)
- 7,5 mmol (≙ 1,13 g) Weinsäure (M=150,09 g/mol)
- 2,5 mmol (≙ 3,51 g) Natriumtartrat-Dihydrat (M=230,08 g/mol)
- Mit Wasser auf 1 l auffüllen.
10 mM Weinsäure (Natrium) Pufferlösung (pH=4,2)
- 2,5 mmol (≙ 0,375 g) Weinsäure (M=150,09 g/mol)
- 7,5 mmol (≙ 1,726 g) Natriumtartrat-Dihydrat (M=230,08 g/mol)
- Mit Wasser auf 1 l auffüllen.
20 mM (Essigsäure) Ethanolamin-Pufferlösung (pH=9,6)
- 20 mmol (≙ 1,2 mL) Monoethanolamin (M=61,08 g/mol, ρ=1,02 g/cm3)
- 10 mmol (≙ 0,575 mL)Essigsäure (Eisessig, 99,5%, 17,4 mol/L)
- Mit Wasser auf 1 l auffüllen.
20 mM (Essigsäure) Ethanolamin-Pufferlösung (pH=9,6)
- 20 mmol (≙ 1,2 mL) Monoethanolamin (M=61,08 g/mol, ρ=1,02 g/cm3)
- 10 mmol (≙ 0,575 mL) Essigsäure (Eisessig, 99,5%, 17,4 mol/L)
- Mit Wasser auf 1 l auffüllen.
100 mM Essigsäure (Natrium) Pufferlösung (pH=4,7)
- 50 mmol (≙ 6,80 g) Natriumacetat-Trihydrat (M=136,08 g/mol)
- 50 mmol (≙ 2,87 mL) Essigsäure (Eisessig) (99,5 %, 17,4 mol/L)
- Mit Wasser auf 1 l auffüllen.
100 mM Borsäure (Kalium) Pufferlösung (pH=9,1)
- 100 mmol (≙ 6,18 g) Borsäure (M=61,83 g/mol)
- 50 mmol (≙ 2,81 g) Kaliumhydroxid (M=56,11 g/mol)
- Mit Wasser auf 1 l auffüllen.
100 mM Borsäure (Kalium) Pufferlösung (pH=9,1)
- 100 mmol (≙ 6,18 g) Borsäure (M=61,83 g/mol)
- 50 mmol (≙ 2,00 g) Natriumhydroxid (M=40,00 g/mol)
- Mit Wasser auf 1 l auffüllen.
Vorbereitung der mobilen Phasen
Unterschiede in der Vorbereitungsmethode können zu unterschiedlichen Chromatogrammen führen.
Als mobile Phase für die HPLC wird hauptsächlich ein Lösungsmittel auf Wasserbasis, ein organisches Lösungsmittel oder eine Mischung aus beiden verwendet. Als wässriges Lösungsmittel wird häufig eine Pufferlösung verwendet. Der Abschnitt „Vorbereitung von Pufferlösungen“ beschreibt die eigentlichen Vorbereitungsmethoden für typische Pufferlösungen, die bei der HPLC verwendet werden. Es scheint jedoch, dass viele Menschen nur ein vages Verständnis von Pufferlösungen haben.
Wenn die Vorbereitungsmethode nicht mit der im Material für die Analysemethode beschriebenen Methode übereinstimmt, können Unterschiede in der mobilen Phase auftreten, die sich auf die Chromatogramme und Analyseergebnisse auswirken. Abgesehen von der Pufferlösung gibt es viele andere unvorhergesehene Faktoren, die sich auf die Vorbereitung der mobilen Phase auswirken, wie z. B. die Methode zum Mischen des Lösungsmittels.
Anhand von konkreten Beispielen werden die Auswirkungen der Vorbereitungsmethode für die mobile Phase auf die Analyseergebnisse untersucht.
1.) Herstellen von Pufferlösungen
Wie bereitet man in der Praxis eine Pufferlösung vor, die als „20 mM Phosphorsäure-Pufferlösung (pH=2,5)“ bezeichnet wird? Untersuchen wir ein paar mögliche Probleme.
Erstens wissen wir, dass es sich um eine Phosphorsäure-Pufferlösung handelt, aber was ist das Gegenion? Wenn Natriumionen eindeutig das Gegenion sind, bezieht sich dann die Angabe „20 mM“ auf die Phosphorsäurekonzentration oder auf die Natriumphosphatkonzentration?
Bei einer 20 mM Phosphorsäure-(Natrium-)Pufferlösung könnte man „20 mM“ als die Phosphorsäurekonzentration betrachten. Wenn man andererseits „20 mM“ als die Natriumkonzentration betrachtet, könnte die Pufferlösung eine Pufferlösung sein, die durch Einstellen des pH-Wertes mit einer 20 mM wässrigen Lösung von Natriumdihydrogenphosphat hergestellt wird. (Eine 20 mM wässrige Lösung von Natriumdihydrogenphosphat hat jedoch einen pH-Wert von knapp unter 5, so dass eine pH-Einstellung mit einer Säure erforderlich ist, um einen pH-Wert von 2,5 zu erreichen).
Allerdings könnte ein Ionenpaareffekt aufgrund der zur pH-Einstellung verwendeten Säure die Analyseergebnisse beeinträchtigen. Dies ist potenziell gefährlich, da es zu mehreren möglichen Interpretationen einer als Pufferlösung bezeichneten Lösung führt.
Das obige Beispiel führt zu drei möglichen Interpretationen. Abb. 1 zeigt, wie sich dies auf die Analyseergebnisse auswirkt.
Im oberen Chromatogramm (A) wird „20 mM“ als die Phosphorsäurekonzentration interpretiert. Die Analyseergebnisse wurden mit einem als „20 mM Phosphorsäure (Natrium) Pufferlösung (pH 2,5)“ hergestellten Lösungsmittel als mobile Phase erzielt.
Im mittleren Chromatogramm (B) und unteren (C) wird „20 mM“ als die Natriumdihydrogenphosphat-Konzentration interpretiert. Die mobile Phase wurde durch Zugabe von Phosphorsäure oder Perchlorsäure hergestellt, um den pH-Wert auf 2,5 einzustellen.
Diese Unterschiede können sich erheblich auf die Retentionszeit auswirken, wie im Beispiel für Dihydrocodein gezeigt wird, und zu Problemen bei der Robustheit der Analysemethode führen. Die eindeutige Angabe der Pufferlösung bei der Spezifikation der Zubereitungsmethode kann Probleme aufgrund unterschiedlicher Interpretationen verhindern.
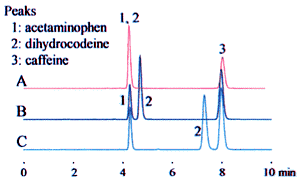
Analytische Bedingungen
Säule Shim-pack VP-ODS (150 × 4.6 mm I.D.)
Mobile Phase
Pufferlösung (pH 2,5) / Acetonitril = 9 / 1
(A) 20 mM Phosphorsäure (Natrium) Pufferlösung (pH 2,5)
(B) 20 mM Natriumdihydrogenphosphat-Pufferlösung (pH2,5); zur Einstellung des pH-Werts wird Phosphorsäure zugesetzt
(C) 20 mM Natriumdihydrogenphosphat-Pufferlösung (pH 2,5); Zugabe von Perchlorsäure zur Einstellung des pH-Werts
Flussrate 1,0 mL/min
Ofentemperatur 40 °C
Detektor 210nm (UV)
2.) Mischen von organischen Lösungsmitteln und wässrigen Lösungsmitteln
Häufig wird eine gemischte Lösung aus organischen und wässrigen Lösungsmitteln als mobile Phase verwendet. Die Art und Weise, wie sie gemischt werden, kann große Unterschiede in den Analyseergebnissen verursachen. Nehmen wir ein Beispiel mit 90 % Pufferlösung und 10 % Acetonitril. (Die Pufferlösung ist 20 mM Natriumdihydrogenphosphat, das durch Zugabe von Phosphorsäure auf pH 2,5 eingestellt wird.) Ein Mischungsverhältnis von 9:1 kann als ein Volumenverhältnis von 9:1 von Pufferlösung und Acetonitril interpretiert werden. Das heißt, die entsprechenden Volumina werden abgemessen und zusammengemischt.
Andererseits ist es möglich, dies als 10 % Acetonitril-Anteil zu interpretieren, d. h., dass das Acetonitril zehnmal mit Pufferlösung verdünnt werden muss. Dies führt dazu, dass sich das Volumen durch das Mischen verringert, so dass überschüssige Pufferlösung zugegeben wird. Man könnte meinen, dass es keinen großen Unterschied zwischen den beiden gibt. Aber dabei ist Vorsicht geboten, da die Art der Vermischung einen erheblichen Einfluss auf die Analyseergebnisse (insbesondere die Retentionszeit) haben kann, wie in Abb. 2 dargestellt.
Im Allgemeinen wird bei der Herstellung der mobilen Phase für die Hochleistungsflüssigkeitschromatographie das Verhältnis häufig als Flüssigkeit A zu Flüssigkeit B = 3 : 2 (V/V) bezeichnet. Das heißt, das Äquivalent des Volumenverhältnisses 3 der Flüssigkeit A und das Äquivalent des Volumenverhältnisses 2 der Flüssigkeit B werden getrennt abgemessen und miteinander vermischt. (In der Praxis führt dies zu einem Mischungsvolumen, das etwas geringer ist als das Äquivalent der theoretischen Gesamtsumme „5“ für die beiden Flüssigkeiten (3 + 2)).
Das obige Problem kann auch auf die Herstellung von Probenlösungen und anderen Lösungen bezogen werden und nicht nur auf die Herstellung der mobilen Phase.
Jedes Fachgebiet (z. B. Pharmazie und Chemietechnik) hat seine eigenen Gepflogenheiten, was noch mehr Verwirrung stiftet. Achten Sie darauf, dass Sie immer die richtigen Angaben verwenden, um Verwechslungen zu vermeiden und immer reproduzierbare Ergebnisse zu ermöglichen.
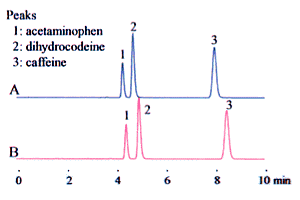
Analytische Bedingungen
Säule Shim-pack VP-ODS (150 × 4.6 mm I.D.)
Mobile Phase
(A) 9:1 (v/v) Mischung aus Pufferlösung und Acetonitril
(B) Mit Pufferlösung auf 10 % (v/v) Acetonitril auffüllen.
Die Pufferlösung besteht aus 20 mM Natriumdihydrogenphosphat, das durch Zugabe von Phosphorsäure auf pH 2,5 eingestellt wird.
Flussrate 1,0 mL/min
Ofentemperatur 40 °C
Detektor 210nm (UV)