Steroidnachweis in Arzneimitteln und Nahrungsergänzungsmitteln mit einem LCMS-8045
Anabolika finden sich häufig in Stichproben von Nahrungsergänzungsmitteln und Arzneimittelzubereitungen, entweder mit Doping-Aktivitäten verbunden [1] oder wegen Kreuzkontaminationen während der Produktion [2]. Methodenentwicklungen zum Nachweis von Steroiden in derartigen Proben können herausfordernd sein; die Technik muss fähig sein, zahlreiche Steroide mit großen Unterschieden in der Polarität nachzuweisen. Die zu überwachenden Verbindungen umfassen relativ polare Steroide wie Anastrozol ebenso wie Steroid-Ester mit geringer Polarität, die zunehmend in Stichproben von Nahrungsergänzungen aufgetreten sind [3].
Die entwickelte Methode prüft auf Testosteroncaproat und Testosteronisocaproat, eine schwierige Isomerenkomposition, die teilweise getrennt wurde (Auflösung 0,6 laut Eur.Ph.), so dass die Analysetechnik nachweisen konnte, welches der beiden Isomere in der Probe enthalten ist. Im Falle des Tibolon, ein synthetisch hergestellter Arzneistoff mit Hormonwirkung, werden drei MRM-Übergänge dargestellt, die auf eine Derivatisierung verzichten, was die Regel ist bei Tibolon und seinen Metaboliten. Zuletzt wird eine umfassende Begründung für die Wahl der MRM-Übergänge bei Steroid-Estern geliefert, die auf Fragmenten der freien Steroide basieren.
Instrumentierung, Methodenparameter und Probenaufbereitung
Die Versuche wurden mit einem Nexera X2 UHPLC-System durchgeführt, das mit einem LCMS-8045 Triple-Quadrupol-Massenspektrometer gekoppelt ist. Das System besteht aus zwei LC-30AD Pumpen, einem SIL-30AC Autosampler und einem CTO-20AC Säulenofen mit einem Flusslinien-Auswahlventil. Das Ventil wurde zur Flussumleitung der mobilen Phase eingesetzt, um die ersten 1,5 Minuten zu verwerfen und eine Kontamination des Massenspektrometers mit früh-eluierenden Matrixkomponenten zu vermeiden.
Die chromatographische Trennung wurde mit einer Zorbax SBC18 Rapid Resolution HT, 50 x 4,6 mm, 3,5 μm (Artikelnummer 835975-902) bei 40 °C erreicht. Als mobile Phase wurde ein Gradient aus 0,1 % wässriger Ameisensäure und Methanol, mit Gradientenelution zur Elution bei einer Flussrate von 0,4 ml/min eingesetzt. Durch diese Parameterwahl ergaben sich Retentionszeiten von 2,4 – 24 Minuten und eine Gesamtlaufzeit von 31 Minuten inklusive Äquilibrierungsschritt.
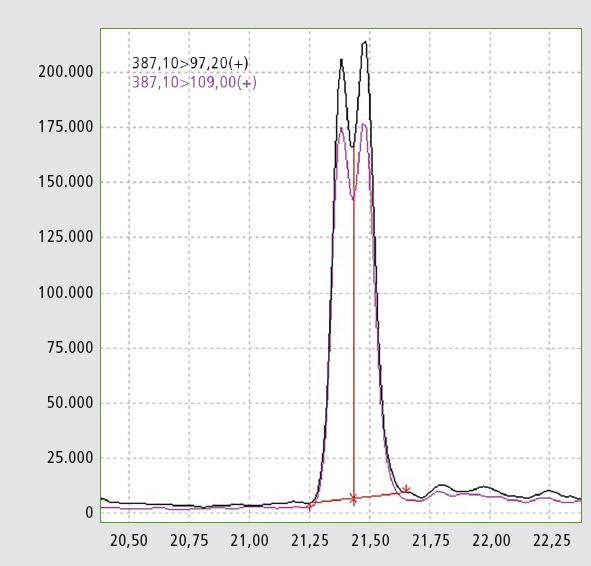
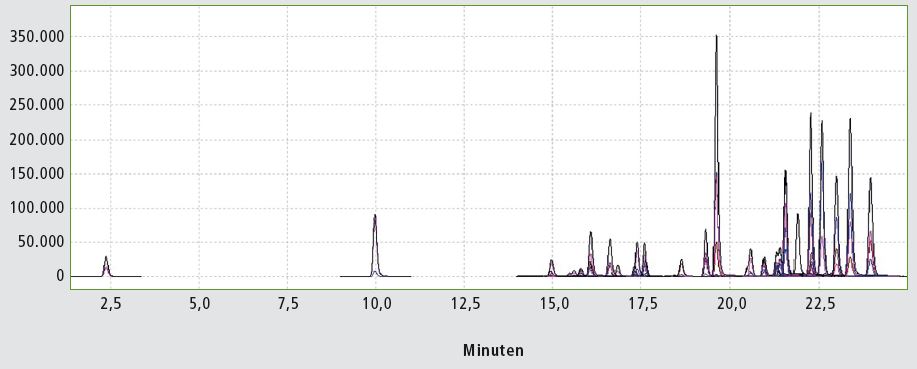
Abbildung 2: Chromatogramm der Standardlösung
| Zeit (min) | % B |
|---|---|
| 0,0 - 5,0 | 35 |
| 5,0 - 20,5 | 35 -> 100 |
| 20,5 - 25,0 | 100 |
| 25,01 - 31,0 | 35 |
Tabelle 1: Gradientenelutionsprogramm
Flüssigchromatographie
Die Strategie der Methodenentwicklung zielte darauf ab, bezüglich der Polarität ein breites Substanzspektrum einzuschließen und gleichzeitig eine angemessene Laufzeit zu gewährleisten – für insgesamt 16 ausgewählte Steroid-Ester. Hinsichtlich der Flussrate der mobilen Phase wurden 0,5 ml/ min und 0,4 ml/min getestet, wobei die letztere aufgrund der gesteigerten Empfindlichkeit gewählt wurde.
Zwei unterschiedlich zusammengesetzte mobile Phasen wurden untersucht, die erste bestehend aus einem Gradienten von 1 mM wässrigem Ammoniumacetat und 1 mM methanolischem Ammoniumacetat sowie die zweite aus einem Gradienten von 0,1 % wässriger Ameisensäure und Methanol. Die zweite mobile Phase wurde gewählt, da sie ein einfacheres Herstellungsverfahren gewährleistet. Die Aziditätsänderung in der mobilen Phase durch Ameisensäure schien geringe Effekte auf die Retentionszeit der Substanzen zu haben, in dem früh-eluierende Verbindungen eine etwa 20 % höhere Retention zeigten, spät-eluierende dagegen eine etwa 10 % höhere Retention.
Zwei Analysesäulen wurden getestet, eine Zorbax SB-C18 Rapid Resolution HT, 50 x 2,1 mm, 1,8 μm (Artikelnummer 822700- 902) und eine Zorbax SB-C18 Rapid Resolution HT, 50 x 4,6 mm, 3,5 μm (Artikelnummer 835975-902). Da die erste Säule Partikel unterhalb von 2 μm enthält, war eine erheblich kürzere Probenlaufzeit zu erwarten, jedoch wurden mit beiden Säulen vergleichbare Retentionszeiten erhalten. Da eine UHPLC-Säule für Überdruck und Verstopfen nach wenigen Analysen anfällig ist, wurde eine 3,5 μm-Säule für die Aufgabe bevorzugt – mit einem Injektionsvolumen von 2 μl.
Die Temperatur des Autosamplers wurde anfänglich auf 4 °C eingestellt, um die Stabilität der Proben sicherzustellen. Da eine starke Ausfällung von Matrixkomponenten beobachtet wurde sobald die Fläschchen 4 °C ausgesetzt wurden, wurde der Autosampler auf Raumtemperatur gehalten und eine 24-stündige Stabilität für die Analyten etabliert.
| Gruppe | Vorläufer-Ion | Produkt-Ion 1 | Produkt-Ion 2 |
|---|---|---|---|
| TESTOSTERON | |||
| Testosteron | 289,4 | 109,1 | 97,0 |
| Methyltestosteron | 303,4 | 109,1 | 97,1 |
| Testosteronpropionat | 345,1 | 109,1 | 97,0 |
| Testosteronphenylpropionat | 421,6 | 105,1 | 97,1 |
| Testosteronisocaproat | 387,1 | 109,0 | 97,2 |
| Testosteroncaproat | 387,1 | 109,0 | 97,2 |
| Testosteronenanthat | 401,6 | 271,3 | 183,0 |
| Testosterondecanoat | 443,7 | 109,2 | 97,0 |
| Testosteronundecanoat | 457,7 | 109,0 | 97,1 |
| TRENBOLON | |||
| Methyltrenbolon | 285,0 | 227,1 | 198,0 |
| Trenbolonacetat | 313,0 | 253,1 | 107,5 |
| Trenbolonenanthat | 383,1 | 253,1 | 107,5 |
| Trenbolonhexahydrobenzylcarbonat | 411,1 | 253,0 | 107,5 |
| NANDROLON | |||
| Nandrolon | 275,4 | 257,2 | 239,0 |
| Nandrolonphenylpropionat | 407,1 | 257,1 | 105,2 |
| Nandrolondecanoat | 429,7 | 257,3 | 239,0 |
| METHENOLON | |||
| Methenolon (nur zur Referenz) | 303,0 | 83,0 | 187,0 |
| Methenolonacetat | 345,0 | 83,1 | 97,0 |
| Methenolonenanthat | 415,1 | 82,9 | 187,1 |
| BOLDENON | |||
| Boldenon (nur zur Referenz) | 287,5 | 134,6 | 120,5 |
| Boldenoncypionat | 411,6 | 135,4 | 125,1 |
| Boldenonundecylenat | 453,2 | 135,2 | 67,2 |
| DROSTANOLON | |||
| Drostanolon (nur zur Referenz) | 305,0 | 161,0 | 215,2 |
| Drostanolonpropionat | 361,1 | 269,2 | 215,2 |
Tabelle 2: Prinzip der Auswahl von MRM-Übergängen
Probenaufbereitung
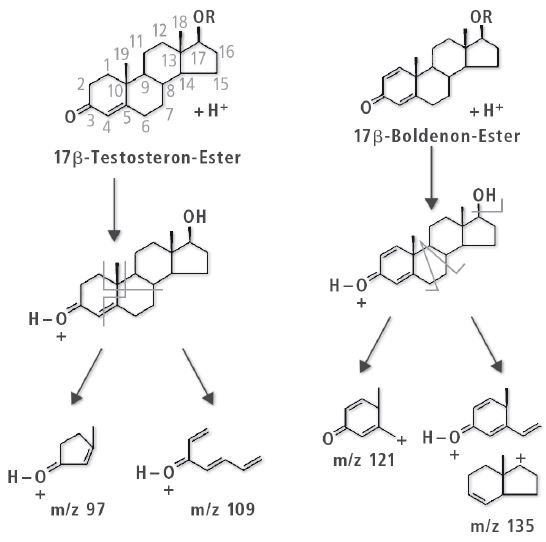
Die zu bestimmenden Verbindungen wurden in sechs Gruppen ähnlicher Struktur unterteilt: Testosteron und Testosteronester, Trenbolonester, Nandrolon und Nandrolonester, Methenolonester, Boldenonester und Drostanolonester. Von den Fragmenten der Steroid-Ester der gleichen Gruppe wird erwartet, bis zu einem gewissen Grade übereinzustimmen; das wurde im Verlauf der anfänglichen massenspektrometrischen Experimente bestätigt, wie in Tabelle 2 ersichtlich. Daher können die gemeinsamen, dort aufgeführten Fragmente genutzt werden, MRM-Übergänge für andere Steroid-Ester zu wählen, die auf Fragmenten der freien Steroide basieren.
Hinsichtlich der Testosteron-Gruppe wurde m/z 109 zur Quantifizierung verwendet und m/z 97 zur Bestätigung. Beide Ionen sind charakteristische Testosteron-Fragmente, und ihr Einsatz ist in der Literatur belegt [1-3]. Da sich die beiden Ionen mit Fragmenten des Steroid-Kerns im Molekül decken, wurde darüber hinaus ihre Eignung für alle Testosteronester untersucht und bestätigt. Ein vergleichbares Prinzip wurde bei der Nandrolonund Nandrolonester-Gruppe verfolgt, m/z 257 und m/z 239. Für die Gruppe der Trenbolonester wurde m/z 253 und m/z 107 verwendet, für die Gruppe der Boldenonester m/z 135 und für Drostanolonpropionat m/z 215.
Die optimierten massenspektrometrischen Parameter lauten:
Positive Ionisierung: (ESI, Kapillarspannung -4 kV)
Heizblock temp.: 400 °C
Desolvatisierungstemp.: 250 °C
Heizgastemp.: 350 °C
Trocknungsgasfluss: 10,0 l/min
Zerstäubergasfluss: 3,0 l/min
Heizgasfluss: 10,0 l/min
Die Verweilzeit wurde auf 20 ms eingestellt, ausgenommen:
Nandrolon: 100 ms
Fluoxymesteron: 50 ms
Methyltrenbolon: 150 ms
Methenolonazetat: 50 ms
Drostanolonpropionat: 150 ms
Fazit
Eine Analysemethode wurde entwickelt, um 31 Steroide in Arzneimitteln und Nahrungsmittelergänzungen nachzuweisen. Dies ist die erste Methode zur Identifikation von Testosteroncaproat in Gegenwart seines Isomers Testosteronisocaproat, und umgekehrt. Schlüsselparameter, die die Analyse der 31 Steroide beeinflussen, wurden ermittelt und berücksichtigt.
Autoren
Dr. Gerasimos Liapatas, Dr. Manos Barbounis
Applications Department of N.Asteriadis S.A.
mb@asteriadis.gr

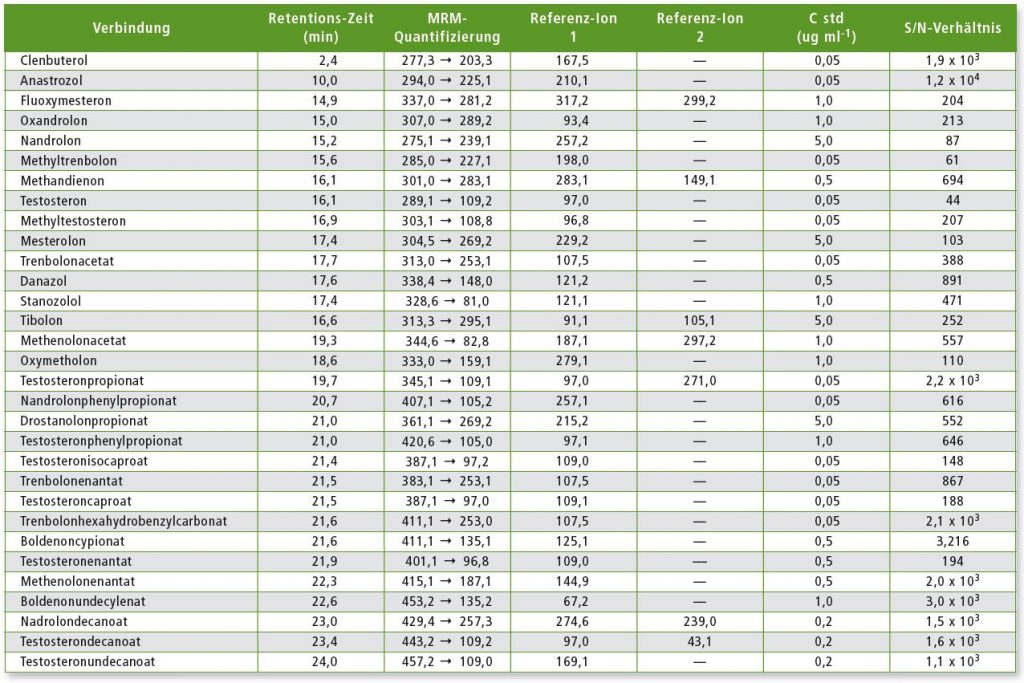
Tabelle 3: MRM-Übergänge für jede Komponente
Literatur
[1] C. Borges, N. Miller, M. Shelby, M. Hansen, C. White, M.H. Slawson, K. Monti, D.J. Crouch, Analysis of a challenging subset of World Anti Doping Agency-Banned steroids and anti-estrogens by LC-MS-MS, Journal of Analytical Toxicology, 31 (2007) 125-131.
[2] S. Fekete, J. Fekete, K. Ganzler, Validated UPLC method for the fast and sensitive determination of steroid residues in support of cleaning validation in formulation area, Journal of Pharma – ceutical and Biomedical analysis, 49 (2009) 833-838.
[3] M. Thevis, Y. Schrader, A. Thomas, G. Sigmund, H. Geyer, W. Schanzer, Analysis of confiscated black market drugs using chromatographic and mass spectrometric approaches, Journal of Analytical Toxicology 2008;32:232-240.