Quantifizierung von Neonicotionoiden, Fipronil und einigen Metaboliten mit UHPLC-MS/MS
Neonicotionoide werden weit verbreitet als Insektizide zum Schutz von Feldern, Früchten und Gemüse eingesetzt.
In jüngster Zeit wird der Gebrauch zunehmend kritisiert, da sie als eine mögliche Ursache des Bienensterbens gelten (engl.: Honeybees Colony Collapse Disorder (CCD)). Da Bestäubung essentiell für die Landwirtschaft ist, fanden ausgedehnte Studien zur Beurteilung der Auswirkungen von Neonicotionoiden auf die Bienengesundheit statt. Als Folge dessen beschränkte die European Food Safety Authority (EFSA) die Nutzung von Thiamethoxam, Clothianidin und Imidacloprid. Fipronil, ein Pestizid einer anderen Substanzklasse, wurde aufgrund des hohen Risikos für die Honigbienengesundheit von der EFSA ebenso für die Behandlung von Maissaatgut verboten.
Probenvorbereitung
Die Probenvorbereitung erfolgte mit Hilfe der QuEChERS-Methode (Quick, Easy, Cheap, Effective, Rugged and Safe) einschließlich dispersiver Festphasenextraktion (dSPE). Thiamethoxam-d3, Imidacloprid-d4 und Chlothianidin-d3 wurden als interne Standards genutzt.
5 g ± 0.05 g Honig wurden in ein 50 ml Zentrifugengefäß aus Polypropylen eingewogen und mit 5 μl der internen Standardlösung (5 µg/ml je Analyt in Acetonitril) versetzt. Nach zehnminütigem Trocknen wurden 10 ml Reinstwasser hinzugefügt und die Proben eine Minute mit einem Laborschüttler homogenisiert. Nach Zugabe von 10 ml des Extraktionsmittels Acetonitril folgte einminütiges Schütteln mit dem Laborschüttler.
Nach einer Inkubationszeit von einer Stunde bei Raumtemperatur und leichtem Schütteln wurde eine kommerziell erhältliche Vormischung der QuEChERS-Salze (4 g Magnesiumsulfat, 1 g Natriumcitrat, 0,5 g Natriumcitrat-Sesquihydrat, 1 g Natriumchlorid, Fa. Biotage) hinzugegeben. Nach händischem Schütteln wurden die Proben mit 3000 g bei 10 °C für 5 min zentrifugiert.
Für die anschließende dSPE wurden 15 ml Zentrifugengefäße der Firma Biotage verwendet, die bereits befüllt mit 1200 mg Magnesiumsulfat, 400 mg PSA-Festphase und 400 mg C18-Festphase geliefert werden. Nach dem Überführen von 6 ml des Überstandes aus der Extraktion in dieses Gefäß, folgten Schütteln und zehnminütiges Zentrifugieren mit 3000 g bei 10 °C. Nach Überführen des Überstandes in ein inertes, zertifiziertes Glasvial (Shimadzu LabTotal Vial, P/N 227-34001-01) erfolgte die Messung mit dem LC-MS/MS-System.
Wiederfindung
Ein Blütenhonig aus dem lokalen Supermarkt wurde pur und nach dem Versetzen mit 50 ppt der Analyten aufgearbeitet und gemessen um Analytverluste und unbekannte Wechselwirkungen zu ermitteln. Die Ergebnisse sind in Tabelle 1 zusammengefasst.
Die berechneten Wiederfindungen liegen im laut EU SANTE/11945/2015 zulässigen Bereich von 70 bis 120 %.
| Verbindung | Wiederfindungen | Verbindung | Wiederfindungen |
|---|---|---|---|
| Acetamiprid | 78,8% | Fipronil-Sulfon | 74,2% |
| Acetamiprid-N-Desmethyl | 93,4% | Imidaclorpid | 83,2% |
| Chlothianidin | 70,6% | Nitenpyram | 87,0% |
| Dinotefuran | 76,5% | Thiacloprid | 82,2% |
| Fipronil | 78,1% | Thiamethoxam | 75,6% |
Tabelle 1: Gemessene Wiederfindungen in Honig
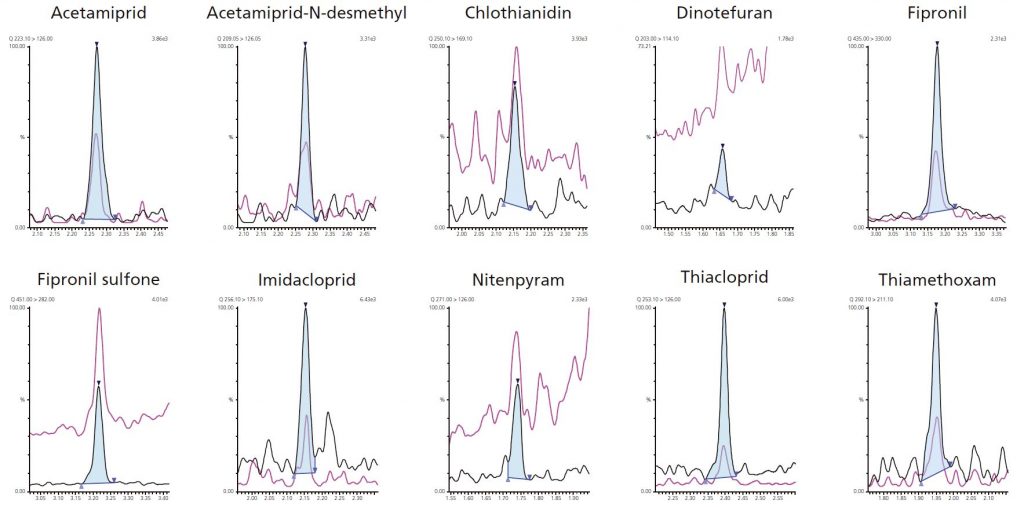
Abb. 1: Chromatogramme der Analyten an ihrem unteren Quantifizierungslimit (LLOQ)
| Nexera X2 | LCMS-8060 | ||
|---|---|---|---|
| Säule | ACE SuperC18 (100 mm L. x 2,1 mm I.D., 2 μm) | Ionisierung | Beheizte ESI |
| Säulentemperatur | 30°C | ESI-Spannung | +1 kV (positive Ionisierung) / -1,5 kV (negative Ionisierung) |
| Mobile Phasen | A: Wasser = 0,05% Ammoniak B: Methanol + 0,05% Ammoniak | Temperatur | Interface Temperatur: 400 °C Desolvation line: 200 °C Heat Block: 400 °C |
| Flussrate | 600 μl/min | Gas | Nebulizing Gas: 3 l/min Heating Gas: 10 l/min Drying Gas: 5 l/min |
| Gradient | 5 % B auf 100 % B in 3 min 100 % B auf 5 % B in 0,1 min | ||
| Gesamtlaufzeit | 4 min | ||
| Injektionsvolumen | 2 μl (POISe-Modus mit 10 μl Wasser*) |
* bei diesem Injektionsmodus werden 2 µl Injektionslösung in der Autosamplernadel mit 10 µl Wasser verdünnt.
Tabelle 2: Analytische Bedingungen
| Name | Polarität | MRM Quan | MRM Qual | ISTD |
|---|---|---|---|---|
| Acetamiprid | + | 223.1 > 126.0 | 223.1 > 56.1 | 2 |
| Acetamiprid-N-desmethyl | + | 209.1 > 126.0 | 211.1 > 128.0 | 2 |
| Clothianidin | + | 250.1 > 169.1 | 250.1 > 132.0 | 3 |
| Dinotefuran | + | 203.0 > 114.0 | 203.0 > 87.0 | 1 |
| Fipronil | - | 435.0 > 330.0 | 435.0 > 250.0 | 3 |
| Fipronil sulfone | - | 451.0 > 415.0 | 451.0 > 282.0 | 3 |
| Imidacloprid | + | 256.1 > 175.1 | 258.1 > 211.1 | 2 |
| Nitenpyram | + | 271.0 > 126.0 | 271.0 > 225.0 | 3 |
| Thiacloprid | + | 253.1 > 126 | 253.1 > 90.1 | 1 |
| Thiamethoxam | + | 292.1 > 211.1 | 292.1 > 181.1 | 1 |
| Thiamethoxam-D3 | + | 295.1 > 214.05 | - | 1 |
| Imidacloprid-D4 | + | 260.1 > 179.1 | - | 2 |
| Clothianidin-D3 | + | 253.1 > 132.05 | - | 3 |
| Dwell Time | 3 bis 34 ms, die Zeit wird automatisch über die Steuerungssoftware LabSolutions LCMS so eingestellt, dass 30 Datenpunkte pro Peak aufgenommen werden (maximale Zeit pro Datenpunkt 140 ms) |
| Pause Time | 1 ms |
| Q1- und Q3-Quadrupolauflösung | Unit 0,7 FWHM |
Tabelle 3: MS/MS-Parameter
Kalibrierung
Eine Kalibrierkurve im Bereich 0,5 pg/ml (1 fg absolut injizierte Substanz auf der Säule) bis 5 ng/ml wurde gemessen. Diese Konzentrationen entsprechen 1 ng/kg bis 10 μg/kg im Honig.
Für jede Verbindung wurden die LLOQs so gewählt, dass eine Richtigkeit zwischen 80 und 120 % erzielt wurde (siehe Tabelle 4). Eine typische Kalibrierkurve ist in Abb. 2 zu sehen.
| Verbindung | LOQ (μg/kg) | Verbindung | LOQ (μg/kg) |
|---|---|---|---|
| Acetamiprid | 0,005 | Fipronil-Sulfon | 0,001 |
| Acetamiprid-N-Desmethyl | 0,005 | Imidaclorpid | 0,020 |
| Chlothianidin | 0,020 | Nitenpyram | 0,020 |
| Dinotefuran | 0,010 | Thiacloprid | 0,005 |
| Fipronil | 0,001 | Thiamethoxam | 0,005 |
Tabelle 4: Bestimmungsgrenzen (LOQ) in Honig
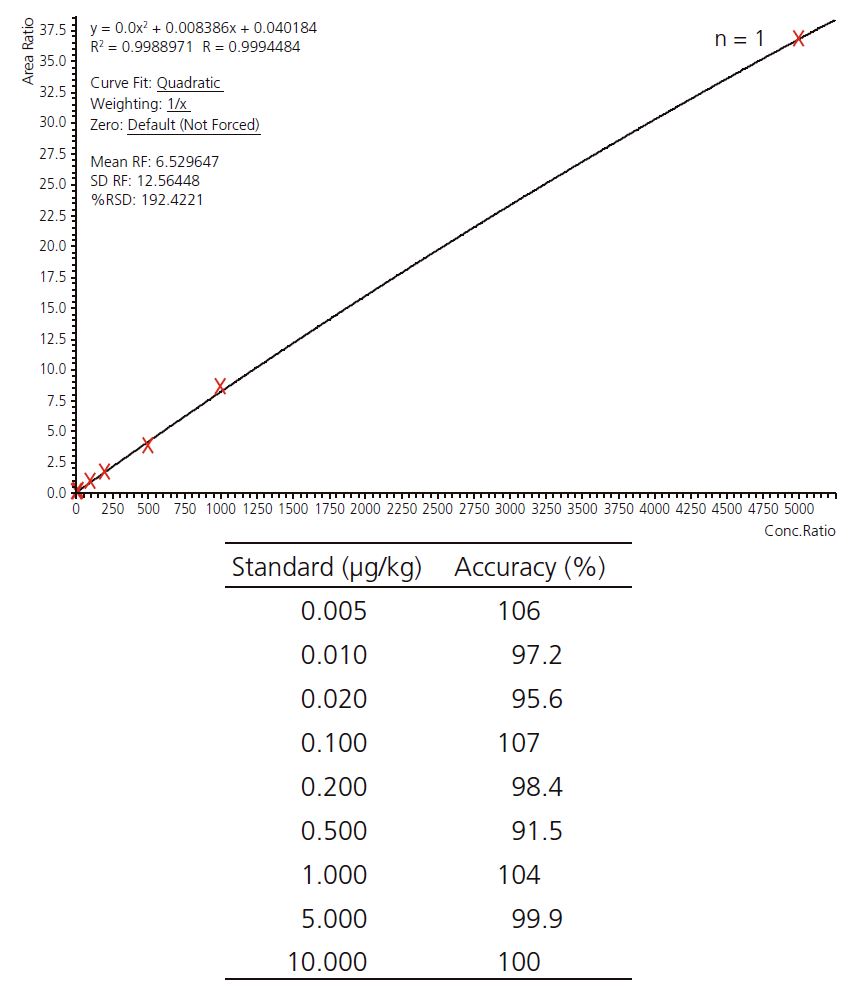
Abb. 2: Kalibrierkurve von Acetamiprid
Stichproben-Analyse
Neun Honigproben aus dem lokalen Supermarkt, bzw. solche die als Rohstoffe für Kosmetika verwendet werden (Orangenbaumhonig), wurden untersucht.
Alle getesteten Honige wiesen Konzentrationen deutlich unter dem zugelassenen Rückstandshöchstgehalt auf. Dank der sehr hohen Empfindlichkeit, konnten sogar besonders niedrige Konzentrationen von Neonicotionoiden quantifiziert werden. Ergebnisse sind in Tabelle 5 abgebildet. Ein repräsentatives Chromatogramm von einem der untersuchten Honige ist in Abbildung 3 zu sehen.
| Honig | Acetamiprid | Chlothianidin | Imidaclorpid | Thiacloprid | Thiamethoxam |
|---|---|---|---|---|---|
| Provence cremig | - | - | 0,20 | - | 0,010 |
| Italien cremig | 0,15 | - | 0,17 | - | - |
| Pyrenäen flüssig | 0,38 | - | 0,043 | 0,020 | - |
| Französisch-spanisch cremig | 0,27 | - | 0,047 | 0,020 | - |
| Thymian flüssig | - | - | - | - | - |
| Zitronenbaum cremig | 1,7 | - | 0,15 | 0,033 | - |
| Orangenbaum flüssig | 1,2 | - | 0,62 | - | - |
| Blüten cremig | 0,14 | - | 0,055 | 0,39 | - |
| Blüten flüssig | 0,34 | - | 0,11 | 0,010 | - |
| Honig | Acetamiprid | Chlothianidin | Imidaclorpid | Thiacloprid | Thiamethoxam |
|---|---|---|---|---|---|
| Provence cremig | - | 0,052 | 0,005 | - | - |
| Italien cremig | - | 0,040 | - | - | - |
| Pyrenäen flüssig | - | - | 0,015 | 0,004 | - |
| Französisch-spanisch cremig | - | 0,032 | - | - | - |
| Thymian flüssig | - | - | - | - | - |
| Zitronenbaum cremig | - | - | 0,020 | - | - |
| Orangenbaum flüssig | - | 0,024 | 0,018 | - | - |
| Blüten cremig | - | - | 0,016 | - | - |
| Blüten flüssig | - | - | 0,006 | - | - |
Tabelle 5: Konzentrationen in den untersuchten Honigen (in μg/kg)
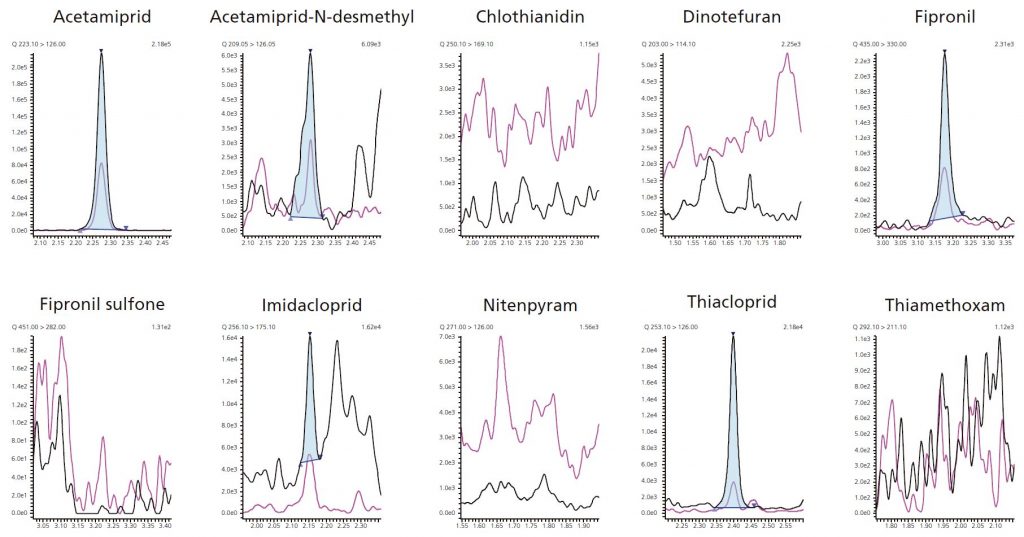
Abb. 3: Chromatogramm einer untersuchten Honigprobe (Pyrenän)
Stabilität
Als Analyt-freie Honigprobe wurde der Thymian-Honig vor der Extraktion zu einer Konzentration von 50 ng/kg mit den Analyten aufgestockt und der erhaltene Extrakt 150-mal hintereinander injiziert.
Die Ergebnisse in Abbildung 4 zeigen eine exzellente Stabilität des Signals, selbst bei sehr geringen Konzentrationen. Das veranschaulicht, dass die exzellente Empfindlichkeit des Systems auch über lange Probenserien aufrechterhalten werden kann.
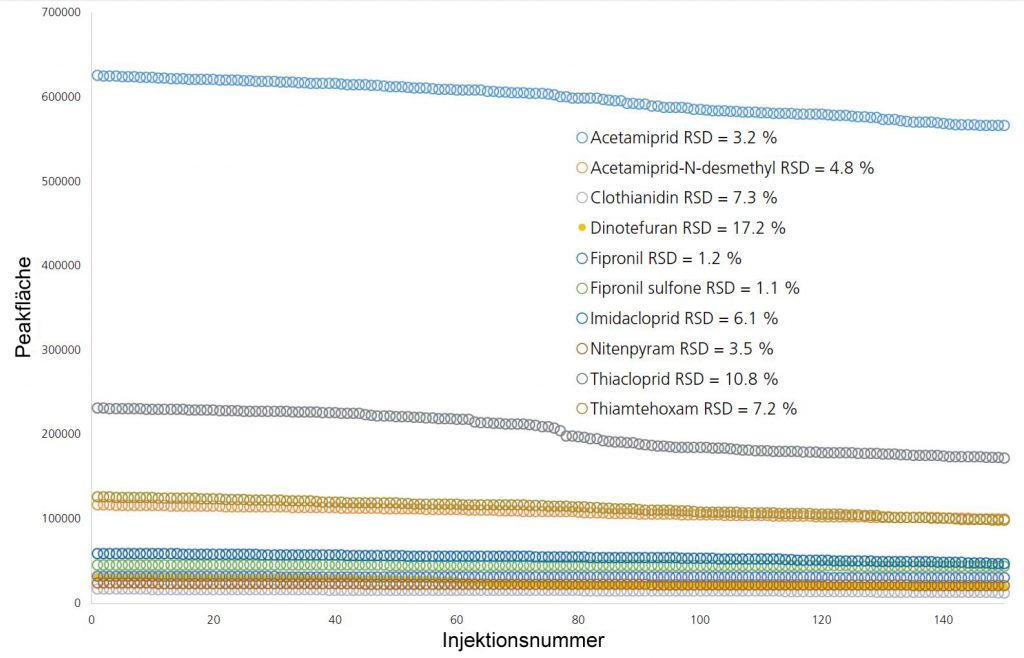
Abb. 4: Stabilität der Peakflächen in Honigstichproben
Fazit
Die hier beschriebene Methode für die hochempfindliche Untersuchung von Neonicotinoiden im Honig wurde erfolgreich mit Realproben getestet. Die einfache Probenvorbereitung lieferte exzellente Wiederfindungen. Der genutzte Injektionsmodus beugt Fehler durch manuelles Verdünnen vor.
Dank der hohen Empfindlichkeit konnten Stichproben mit sehr niedrigen Konzentrationen weit unter den vorgegebenen Rückstandshöchstgehalten untersucht werden. Darüber hinaus zeigtbewies das System (Shimadzu Nexera X2 mit Shimadzu LCMS-8060) auch bei niedrigen Messkonzentrationen seine Stabilität nach langen analytischen Serien von Stichproben.
Diese Methode ist ein höchst effizientes Werkzeug, um die Anreicherung von Neonicotinoiden in Honigbienenkolonien besser zu verstehen. Die Methode könnte außerdem einfach auf Pollen- oder Bienenproben übertragen werden.