Reinheit von orthopädischen Implantaten: Beurteilung unter Verwendung der TOC-Methode
Orthopädische Implantate sind Medizinprodukte, die verwendet werden, um beschädigte Knochen oder Gelenke zu ersetzen. Derartige Implanate, sowie die eingesetzten Operationstechniken werden stetig weiterentwickelt; die Zahl der Operationen steigt ständig an. Die Anforderungen die hinsichtlich der Biokompatibilität von Materialen und Reinheit nach der Produktion an derartige Implantate gestellt werden, sind hoch. Denn es gilt das Risiko von Gesundheitsschäden oder gar einer Implantat-Abstoßung für den Patienten zu minimieren. Aus diesem Grund sind effektive Methoden zur Reinigung und zur Beurteilung der Reinheit bei der Herstellung von Implantaten von großer Bedeutung.

Die ISO19227:2018 beschreibt Richtlinien und geeignete Verfahren zur Beurteilung der Reinheit von orthopädischen Implantaten. Ein Summenparameter, der sich zur Bestimmung der wasserlöslichen organischen Verunreinigungen etabliert hat, ist der TOC (Total Organic Carbon).
Die TOC-Messung ermöglicht zwar keine Identifizierung der einzelnen Kontaminanten, kann aber die Gesamtmenge der organischen Verunreinigung präzise bestimmen. Der Parameter wird häufig auch bei der Reinigungsvalidierung für pharmazeutische Produktionsanlagen verwendet.
Probenvorbereitung
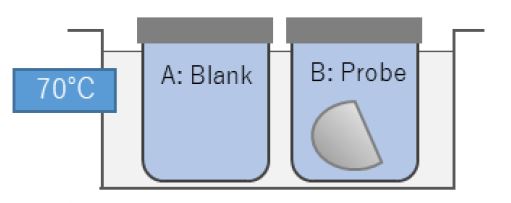
Für die Beurteilung der Reinheit eines Implantats mittels TOC-Bestimmung wurde eine Probe (femorale Komponente eines Knieimplantats, Abb. 1) in folgender Weise aufgearbeitet:
1. Zwei Bechergläser wurden mit je 250ml Reinstwasser befüllt und in einem auf 70°C temperierten Ultraschallbad platziert. Behälter (A) dient zur Blindwertermittlung.
2. Das gereinigte Implantat wurde in Behälter (B) gelegt. Dabei ist darauf zu achten, saubere und sterile Schutzausrüstung zu tragen, um die Probe nicht zu kontaminieren.
3. Extraktion im Ultraschallbad für eine Stunde. Danach wurde das Implantat entfernt und beide Flüssigkeiten (A) und (B) in Autosampler Vials umgefüllt.
4. Durchführung der TOC-Analyse von Blindwert (A) und Extraktionsflüssigkeit (B).
Versuche
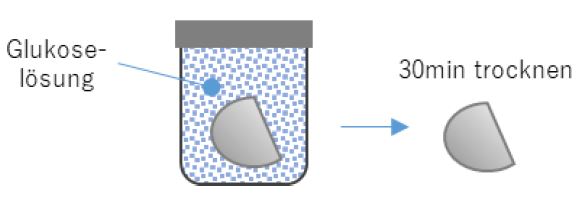
Im nächsten Schritt wurden gezielt organische Verunreinigungen auf die Oberfläche des Implantats aufgebracht. Um diese Verunreinigungen zu simulieren wurde das Implantat zunächst in eine 50 mgC/L Glukoselösung (C) eingetaucht und anschließen in gleicher Weise (Schritte 1 – 4) vorbereitet und gemessen.
Eine weitere Kontamination der Probe wurde durch kurzes Berühren des Implantats mit bloßen Händen (D) erzeugt. Nach Flüssigextraktion und anschließender TOC-Messung, konnte die organische Kontamination auf der Oberfläche des Implantats schnell und präzise erkannt und nachgewiesen werden.
Die Herstellung der Extraktionslösung nach diesem Verfahren ist lediglich ein Beispiel. Tatsächliche Prüfungen am Produktionsstandort sollten unter Berücksichtigung von Temperatur und Zeit in Abhängigkeit von der Beschaffenheit des jeweiligen Produkts durchgeführt werden.
Vorzugsweise wird bei derartigen Extrakten von Implantaten die NPOC-Methode angewandt. Um die anorganischen Kohlenstoffverbindungen zu entfernen wird die Probe angesäuert und ausgegast (Carbonate und Hydrogencarbonate werden zu CO2 umgesetzt und mittels Spülgas entfernt).
Anschließend wird ein Aliquot der Probe auf einen heißen Platinkatalysator injiziert. Hierbei werden die organischen Komponenten zu CO2 oxidiert und mit einem NDIR-Detektor erfasst.
Tab. 1 Messbedingungen

| Analysator | TOC-L(CPH) |
| Katalysator | Hoch Sensitiv |
| Messmodus | TOC (=NPOC9 |
| Kalibrierkurve | Zwei 5-punkt Kalibrierkurven unter Verwendung von KHP-Lösungen bei Kohlenstoff-Konzentrationen von 0,1 - 0,25 - 0,5 - 0,75 - 1 mg/L und 1 - 2,5 - 5 - 7,5 - 10 mg/L |
Ergebnisse
Die TOC-Messergebnisse des Blindwerts und der Extraktionsflüssigkeiten sind in Tab. 2 dargestellt.
Tab. 2 Messergebnisse
| Probe | TOC [mgC/l] | TOC-BW [mgC/l] |
|---|---|---|
| Ultraschallbad Blindwert A | 0,64 | - |
| Extraktionslösung B (sauberes Implantat) | 1,98 | 1,34 |
| Extraktionslösung C (Glukose) | 3,46 | 2,82 |
| Extraktionslösung D (verunreinigt) | 2,48 | 1,84 |
Empfohlenes Gerät / Ausstattung
TOC-L (CPH)
ASI-L