Untersuchung von Mykotoxinen in Bieren mit verschiedenen Reinigungstechniken unter Verwendung des Mycotoxin Screening System
1. Einführung
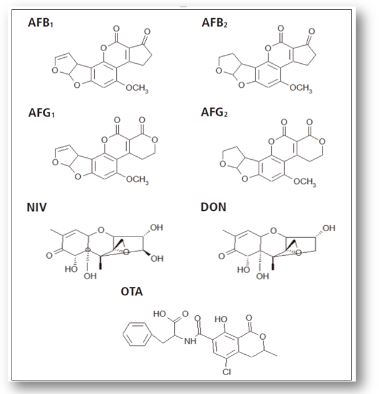
Mykotoxine sind Sekundär-Metaboliten, die von Pilzen produziert werden und sich als toxisch und karzinogen erwiesen haben [1]. Daher ist die Quantifizierung in Lebensmitteln und Getränken von entscheidender Bedeutung, um die Gesundheit von Mensch und Tier zu gewährleisten. Diese Applikation stellt einfache und schnelle Methoden zur Probenvorbereitung und Analyse verschiedener Mykotoxine in verschiedenen Matrices mit dem Shimadzu „Mycotoxin Screening System“ vor. Es ist ein Paket mit gebrauchsfertigen Methoden und Auswertungen zum Screening von Mykotoxinen nach der europäischen Rückstandshöchstgehalt-Richtlinie (European maximum residue levels EU MRL). Diese Arbeit konzentriert sich auf die Bestimmung von Aflatoxin B1, B2 (AFB1, AFB2), G1, G2 (AFG1, AFG2), Deoxynivalenol (DON), Nivalenol (NIV) und Ochratoxin A (OTA), da diese Mykotoxine durch Pilzbefall während oder nach der Ernte von Getreide produziert werden können und daher in verarbeiteten Produkten wie Bier, das aus Malz gebraut wird, enthalten sein können.
Alle interessanten Analyten konnten mit LOQs auf oder unter den europäischen Rückstandshöchstwerten (EUMRL) quantifiziert werden (Tabelle 1). Ein hochempfindlicher Nachweis aller Analyten wurde durch die Kombination von Fluoreszenz- und Photodiodenarray (PDA)-Detektoren erreicht.
| Zielverbindung | Beispiele für Zielprodukt | EU | US (Codex) | Japan |
|---|---|---|---|---|
| Aflatoxin B1, B2, G1, G2 (AFB1, B2, G1, G2) | Getreide, Getreideprodukt (Mehl etc.) | Insgesamt 4~15 μg/kg AFB1 2~12 μg/kg | Insgesamt 10~15 μg/kg | Insgesamt 10 μg/kg |
| Ochratoxin A (OTA) | Weizen, Weizenmehl | 2~10 μg/kg | 5 μg/kg | Nicht reguliert |
| Deoxynivalenol (DON) | Weizen, Weizenmehl | 500~1.750 μg/kg | 1.000 μg/kg | 1100 μg/kg (prov. std. Wert) |
| Nivalenol (NIV) | Weizen, Weizenmehl | Nicht reguliert |
Tabelle 1: Unterschiedliche Mykotoxinvorschriften in der EU, den USA und Japan [2,3]
2. Materialien und Methoden
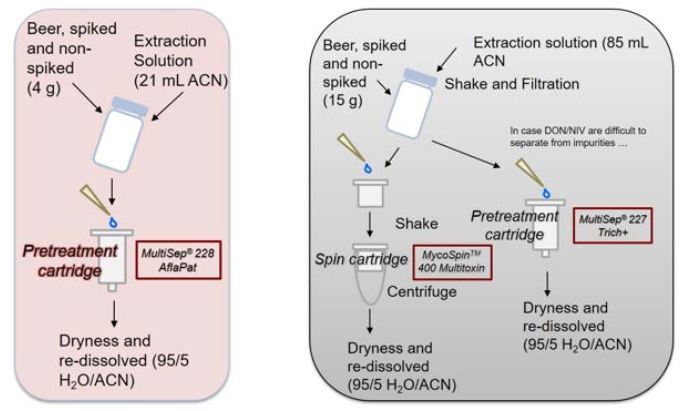
2.1. Probenvorbereitung mit drei verschiedenen SPE-Kartuschen
2.2. Analytische Bedingungen
Für die Analyse wurde ein System der Shimadzu i-Series mit integrierter Fotodiodenzeile (LC-2040C 3D) und zusätzlichem Fluoreszenzdetektor (RF-20AXs) verwendet (Abbildung 2). Die verwendeten detaillierten Analysebedingungen sind in Tabelle 2 dargestellt.

| System | LC-2040C 3D (Shimadzu Corporation, Japan) |
| Säule | Shim-pack GIST C18 3,0 mm x 75 mm, 2 μm (Shimadzu Corporation, Japan) |
| Mobile Phase A | 20 mmol/L NaH2PO4 in H2O, pH 2.5 |
| Mobile Phase B | Acetonitril |
| Mobile Phase C | Methanol |
| Gradient | 5 % B bis 35 % B; 15 % C in 10 Min |
| Injektionsvolumen | 10 μL |
| Ofentemperatur | 55 °C |
Tabelle 2: Analytische Bedingungen für die Analyse von Mykototxinen
3. Ergebnisse
Alle Mykotoxine wurden mit Fluoreszenz- oder PDA-Detektion nachgewiesen. Für NIV und DON wurde die Aufreinigungskartusche MultiSep 227 verwendet. Beide wurden in der gespikten Bierprobe mittels PDA-Detektion eindeutig identifiziert (Abbildung 3).
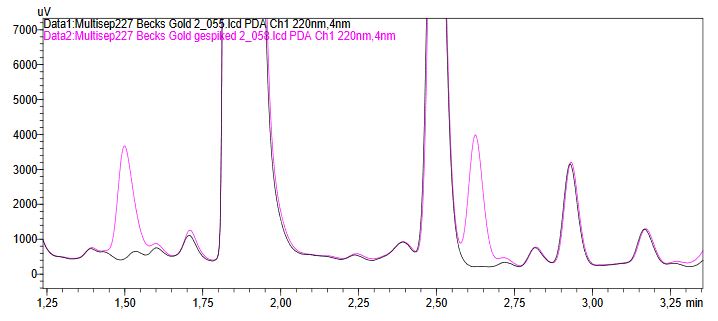
Abbildung 3: PDA-Chromatogramm einer Bierprobe mit und ohne Spikes
Ein Chromatogramm (Fluoreszenzdetektion) einer Bierprobe gespikter und nicht gespikter Bierproben ist in Abbildung 4 zu sehen. Beim Vergleich der unveränderten Bierproben wurde ein Unterschied zwischen den beiden Chargen festgestellt. Das aus der Charge 2 erhaltene Chromatogramm zeigt einen etwas höheren Gehalt an Mykotoxinen als die Probe der Charge 1 (Abbildung 5). Die Konzentrationen liegen jedoch nach wie vor unter den EU-Vorschriften und sind daher akzeptabel; es wurde die Aufreinigungskartusche MultiSep 228 verwendet.
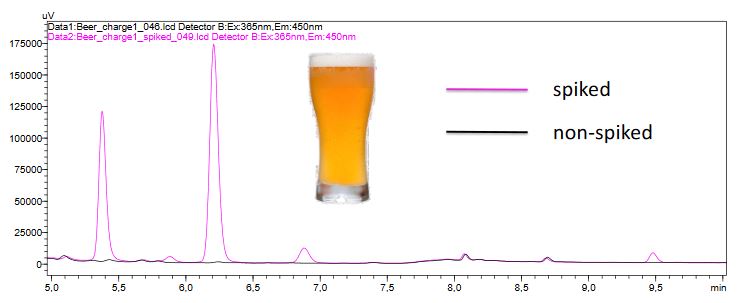
Abbildung 4: Chromatogramm aus der Analyse einer Bierprobe mit und ohne Spikes
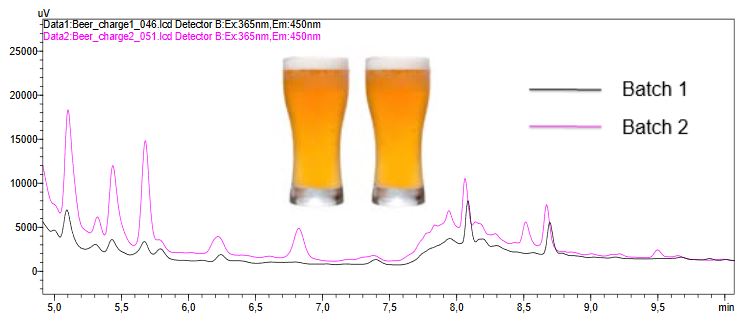
Abbildung 5: Probenvergleich von zwei verschiedenen Chargen derselben Biermarke
Für die Quantifizierung dieser Mykotoxine wurden Kalibrierkurven im Bereich von 2,5 – 25 μg/L hergestellt. Diese Kalibrierkurven weisen eine gute Linearität mit R2-Werten ≥0,97 auf (Abbildung 6).
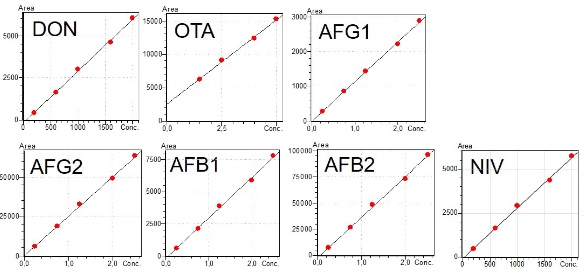
Abbildung 6: Kalibrierkurven von Mykotoxinen von Interesse im Bereich von 2,5 – 25 μg/L
4. Fazit
In dieser Studie wurde die Anwendbarkeit des „Mycotoxin Screening System“ von der Vorbereitung bis zur Analyse und abschließenden Berichterstattung über die Analyseergebnisse bei der gleichzeitigen Analyse von 7 Mykotoxinen gezeigt. AFB1, AFB2, AFG1, AFG2, OTA, DON und NIV, welche am häufigsten in Malzprodukten getestet werden, konnten aus gespikten und nicht gepikten Bierproben extrahiert und nachgewiesen werden. Die Probenvorbereitungstechnik sowie die Messung haben sich als sehr schnell erwiesen. Die analysierten Bierproben enthielten Mykotoxinkonzentrationen, die unter den EU-Vorschriften lagen und boten eine schnelle, sichere und einfache Methode zur Analyse von Mykotoxinen in Getränken wie Bier.
Quellen
[1] European Food Safety Authority (http://www.efsa.europa.eu/de/topics/topic/aflatoxins)
[2] EU: Commission Regulation (EC) No 165/2010 of 26 December 2010 amending Regulation (EC) No 1881/2006. Setting maximum levels for certain contaminants in foodstuffs as regards aflatoxins.
[3] EU: Commission Regulation (EC) No105/2010 of 5 February 2010 amending Regulation (EC) No 1881/2006. Setting maximum levels for certain contaminants in foodstuffs as regards ochratoxin A
Autoren
Carola Schultz1, Gesa Schad1, Robert Ludwig1, Philipp Jochems1, Uwe Oppermann1
1Shimadzu Europa, Albert-Hahn-Str. 6-10, 47269 Duisburg, Germany