Zugversuch an kultivierter Epidermis
in den letzten Jahren regenerative medizinische Produkte* entwickelt, um die Verbreitung der regenerativen Medizin zu erleichtern. Da die Qualitätskontrolle für regenerative Medizinprodukte von entscheidender Bedeutung ist, wurden von der Agentur für Arzneimittel und Medizinprodukte (PMDA), die Überprüfungen durchführt, verschiedene Materialien[1][2] herausgegeben. Obwohl das herausgegebene Material zusätzlich zu den biologischen Bewertungen dynamische Bewertungen fordert, enthalten sie keine Beschreibung spezifischer Bewertungsmethoden. Die dynamische Bewertung wurde bei der Transplantation von iPS-Zell-abgeleiteten retinalen Pigmentepithelzellblättern durchgeführt, aber die Bewertungsmethode war nicht mehr als qualitativ und bestand nur aus Überprüfungen auf Beschädigungen zum Zeitpunkt der Transplantatpräparation.[3] Quantitative Bewertungen werden jedoch wahrscheinlich für Zellblätter[5] erforderlich sein, die mechanische Festigkeit erfordern, wie z.B. kultivierte Hautblätter[4] und Myokardzellblätter. Darüber hinaus ist es möglich, dass im Gegensatz zu den derzeitigen regenerativen Medizinprodukten, die autologe Zellen verwenden, bei regenerativen Medizinprodukten, die allogene Zellen verwenden[6], von denen erwartet wird, dass sie sich in Zukunft durchsetzen werden, Spezifikationsprüfungen auf der Grundlage quantitativer Qualitätsstandards durchgeführt werden müssen.
In dieser Forschung wurden Zugversuche mit kultivierter Epidermis, die ein regeneratives Medizinprodukt ist, und mit Milchmembranen, die kultivierte Epidermis imitieren (von der Oberfläche heißer Milch gesammelt), als Beispiel für eine quantitative Bewertung der mechanischen Eigenschaften eines Materials durchgeführt.
* Regenerative medizinische Produkte sind Gegenstände, die durch die Verarbeitung menschlicher oder tierischer Zellen zur Rekonstruktion, Reparatur oder Formung von Körperstrukturen und -funktionen oder zur Behandlung oder Vorbeugung von Krankheiten hergestellt werden.
Messsystem
Tabelle 1 und Tabelle 2 geben die Systemzusammensetzung bzw. Informationen der Proben an. Abb. 1 zeigt eine kultivierte Epidermis-Probe. Die Tests wurden unter Verwendung von Milchmembranen, die kultivierte Epidermis imitieren (Scheinprobe), und zwei Arten von zu Forschungszwecken kultivierter Epidermis (A und B)* mit unterschiedlicher Festigkeit durchgeführt, die nach derselben Methode wie die für autologe kultivierte Epidermis JACE® hergestellt wurden. Die Dicke der kultivierten Epidermisproben betrug weniger als 100 μm und die Struktur der Proben bestand aus einigen wenigen Schichten epidermaler Zellen. Die Proben waren flexibel und wurden durch Einweichen in Konservierungslösung feucht gehalten. Daher mussten die Proben während der Zugversuche schnell montiert und gemessen werden, um ihre Feuchtigkeit zu erhalten. Abb. 2 ist ein Bild des Versuchs. Für die Halterung werden zylindrische Schwämme verwendet. Indem eine Probe um diese Schwämme gewickelt wird, können die Proben während des Versuchs gehalten werden, ohne sie zu beschädigen. Tabelle 3 zeigt die Prüfbedingungen. Die Prüfgeschwindigkeit wurde auf eine niedrige Geschwindigkeit innerhalb des Geschwindigkeitsbereichs eingestellt, in dem die Proben feucht bleiben.
* Zur Verfügung gestellt von Japan Tissue Engineering Co., Ltd.

Tabelle 1 System-Zusammensetzung
| Testsystem | EZ-LX |
| Wägezelle | 10 N |
| Prüfvorrichtung | Zugtesthalterung für kultivierte Epidermis |
Tabelle 2 Probeninformationen
| Dimensionen | 50 mm × 100 mm; Dicke von weniger als 100 μm |
| Arten | Milchmembran, Kultivierte Epidermis A, Kultivierte Epidermis B |
Tabelle 3 Testbedingungen
| Prüfgeschwindigkeit | 20 mm/min |
| Testumgebung | Raumtemperatur |
Testergebnisse
Abb. 3 zeigt die Last-Verschiebungs-Kurven. Tabelle 4 zeigt die auf jedes Material aufgebrachte maximale Belastung und die Steigung des linearen Teils der Kurven. Die auf ein Material ausgeübte maximale Belastung gibt die Festigkeit des Materials an. Je höher der Wert ist, desto robuster ist das Material also. Die Steigung des linearen Teils der Kurve zeigt die Nachgiebigkeit und damit die Flexibilität der Proben an. Ein deutlicher Unterschied zwischen kultivierter Epidermis A und B wurde in Bezug auf die maximal angewandte Belastung bestätigt. Obwohl es eine gewisse Variation zwischen den Steigungen des linearen Teils der Kurven in der Grafik gab, wurde kein signifikanter Unterschied zwischen den kultivierten Epidermisproben beobachtet.
Tabelle 4 Testergebnisse (Durchschnitt)
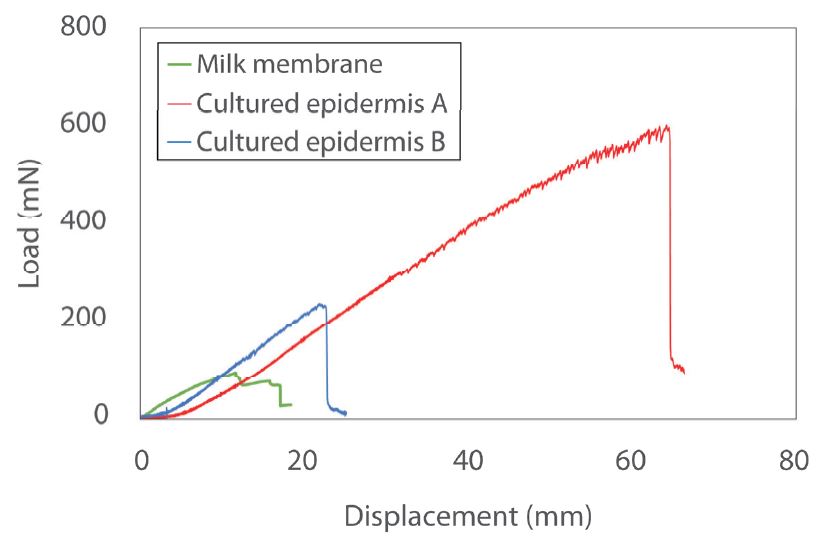
| Probe | Maximale Belastung [mN] | Steigung des linearen Teils [mN/mm] |
|---|---|---|
| Milchmembran | 95 | 10,2 |
| Kult. Epidermis A | 579 | 13,1 |
| Kult. Epidermis B | 237 | 12,6 |
Fazit
In dieser Forschung wurden Zugversuche an kultivierter Epidermis, die ein regeneratives Medizinprodukt ist, und an Milchmembran als Beispiel für eine quantitative Bewertung der mechanischen Eigenschaften eines Materials durchgeführt. Wir waren in der Lage, erfolgreiche Tests durchzuführen und den Unterschied zwischen zwei Arten von kultivierten Epidermisproben zu bestätigen, indem wir unsere neu entwickelte Zugprüfvorrichtung für kultivierte Epidermis benutzten.
Unser Bewertungssystem ermöglicht die Beurteilung der mechanischen Eigenschaften von regenerativen Medizinprodukten und eignet sich für die Entwicklung und Bewertung von regenerativen Medizinprodukten.
Referenzen
[1] PMDA (2016), „Technical Guidance for the Quality of Regenerative Medical Products (Human Cell-Processed Products) and Implementation of Non-Clinical and Clinical Tests“, Notification issued by the Ministry of Health, Labour and Welfare of Japan
[2] PMDA (2012), „Quality and Safety Assurance of Cell-Processed Medical and Pharmaceutical Products“, PFSB Notification No. 0907002 through 0907006
[3] PMDA (2013) „Evaluation Index for Autologous iPS Cell-Derived Retinal Pigment Epithelial Cells“, PFSB/ELD/OMDE Notification No. 0529001
[4] V. Trottier (2008), „IFATS Collection: Using Human Adipose- Derived Stem/Stromal Cells for the Production of New Skin Substitutes“, pp. 2713-2723, Vol. 26, Issue 10, October, STEM CELLS
[5] Satsuki Fukushima (2014), „Developing myocardial regeneration therapy using induced pluripotent stem cells of allogeneic origin“, pp. 199-205, Vol. 21, No. 2, Organ Biology
[6] N. Nakatsuji (2008), „HLA-haplotype banking and iPS cells“, Vol. 26, No. 7, July, Nature Biotechnology